题目内容
【题目】有机物G(1,4-环己二醇)是重要的医药中间体和新材料单体,可通过以下流程制备。

完成下列填空:
(1)写出C中含氧官能团名称_____________。
(2)判断反应类型:反应①_______________;反应③_________________。
(3)写出B的结构简式 _____________________。
(4)一定条件下D脱氢反应得一种产物,化学性质比较稳定,易取代、难加成。该产物属于_________(填有机物类别),说明该物质中碳碳键的特点____________________________。
(5)1,3-丁二烯是应用广泛的有机化工原料,它是合成D的原料之一,它还可以用来合成氯丁橡胶(![]() )。写出以1,3-丁二烯为原料制备氯丁橡胶的单体的合成路线。_________________
)。写出以1,3-丁二烯为原料制备氯丁橡胶的单体的合成路线。_________________
(合成路线常用的表示方式为:![]() )
)
【答案】 羟基 消去 取代 ![]() 芳香烃 所有的碳碳键键长相等,是介于单键和双键之间的特殊的键
芳香烃 所有的碳碳键键长相等,是介于单键和双键之间的特殊的键 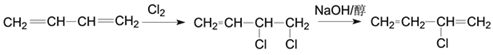
或者:
【解析】(1)C为环已醇,含氧官能团为羟基;(2)反应①是环已醇发生消去反应生成环已烯;反应③是1,4-二溴环已烷发生取代反应(或水解反应)生成1,4-环已二醇。
(3)根据流程信息可知B是由E与溴按1:1发生1,4加成生成的化合物,其结构简式为:![]() ;(4)一定条件下D脱氢反应得一种产物,化学性质比较稳定,易取代、难加成。该产物应该是苯,属于芳香烃;苯中碳碳键的特点是所有的碳碳键键长相等,是介于单键和双键之间的特殊的键;(5)若1,3-丁二烯与氯气按1:1发生1,2加成生成3,4-二氯-1-丁烯,3,4-二氯-1-丁烯在氢氧化钠的乙醇溶液中加热部分消去生成氯丁烯,则合成路线为:
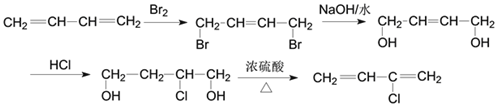
;(4)一定条件下D脱氢反应得一种产物,化学性质比较稳定,易取代、难加成。该产物应该是苯,属于芳香烃;苯中碳碳键的特点是所有的碳碳键键长相等,是介于单键和双键之间的特殊的键;(5)若1,3-丁二烯与氯气按1:1发生1,2加成生成3,4-二氯-1-丁烯,3,4-二氯-1-丁烯在氢氧化钠的乙醇溶液中加热部分消去生成氯丁烯,则合成路线为: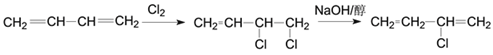 ;若1,3-丁二烯与溴按1:1发生1,4加成生成1,4-二溴-2-丁烯,1,4-二溴-2-丁烯在氢氧化钠的水溶液中加热发生水解反应生成
;若1,3-丁二烯与溴按1:1发生1,4加成生成1,4-二溴-2-丁烯,1,4-二溴-2-丁烯在氢氧化钠的水溶液中加热发生水解反应生成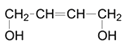 ,
,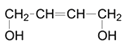 与氯化氢加成反应生成
与氯化氢加成反应生成![]() ,
,![]() 发生消去反应生成氯丁烯,则合成路线为:
发生消去反应生成氯丁烯,则合成路线为: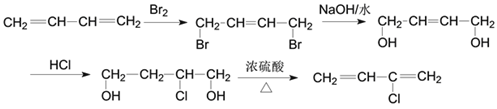 。
。

 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】I.现用下图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1000 mL,供选择的电极材料有纯铜片和纯锌片。请回答下列问题:

(1)b电极材料为__________,其电极反应式为_________________________。
(2)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为__________,此时a电极质量减少__________g。
II.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有:________________________________;
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________________________________;
(3)要加快上述实验中气体产生的速率,还可采取的措施有___________________(答两种);
(4)为了进一步研究硫酸铜的用量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。(假设混合溶液总体积等于混合前各溶液的体积之和)
实验 混合溶液 | A | B | C | D | E | F |
4 mol/L H2SO4 /mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液 /mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O /mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V3=____________, V8=______________;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因_____________________。
③实验A测得:收集到产生H2体积为112mL(标准状况下)时所需的时间为10分钟,求化学反应速率ν(H2SO4)=________________________(忽略反应前后溶液体积变化)。
p>