题目内容
为了探究吸热反应和放热反应,某学习小组设计如下5种装置,装置气密性都良好.请根据要求回答相关问题:
(1)选择装置Ⅲ探究“氢氧化钠与盐酸反应是放热反应”.在试管里装入氢氧化钠固体,分液漏斗里装入稀盐酸,实验过程中观察到烧杯里产生气泡,由此得出实验结论是“NaOH+HCl═NaCl+H2O是放热反应”,该结论存在的两个明显缺陷是
(2)在装置Ⅱ的试管里装入固体氢化钾(KH),滴加适量水,观察到烧杯里澄清石灰水变浑浊,在反应后的试管里滴几滴酚酞溶液,溶液变红色.写出KH与水反应的化学方程式:
(3)实验室有一瓶试剂,标签脱落.假设试剂用M代号表示.某同学取少量M粉末用脱脂棉包裹并置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
①由上述实验现象可得出两条有关M与水反应的结论:
结论1:M与水反应放出氧气;
结论2::M与水反应是
②选择装置Ⅰ验证结论2的实验操作及现象是
③为了进一步探究M的性质,取少量M投入盛有适量水的烧杯里,滴加几滴酚酞溶液,发现溶液变红色,过一会儿,溶液变成无色.查阅资料发现,过氧化钠(Na2O2)和超氧化钾(KO2)都具有M的相似性质,写出KO2与水反应的化学方程式:
(2)根据反应现象判断反应产物为氢氧化钾和氢气;由于澄清石灰水变浑浊,石灰水溶解度减小,证明温度升高;
(3)①脱脂棉剧烈燃烧起来,说明该反应为放热反应;
②将导管b插入水槽中,反应放出热量会使水槽中产生气泡,据此进行设计实验;
③KO2与水反应生成氢氧化钾和氧气,根据化合价升降相等进行配平.
故答案为:氢氧化钠固体溶于水放热,会产生气泡干扰实验;盐酸加入具支试管里会排出气体,会产生气泡干扰实验; 选择氢氧化钠溶液与盐酸在装置Ⅴ的小试管中反应;
(2)在装置Ⅱ的试管里装入固体氢化钾(KH),滴加适量水,观察到烧杯里澄清石灰水变浑浊,在反应后的试管里滴几滴酚酞溶液,溶液变红色,说明反应生成了氢氧化钾,根据KH中氢元素化合价为-1价、水中氢元素+2价可知,反应产物为氢气,反应的化学方程式为:KH+H2O═KOH+H2↑;石灰水变浑浊,说明温度升高,氢氧化钙的溶解度减小,该反应为放热反应,
故答案为:KH+H2O═KOH+H2↑;放热;
(3)①往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来,说明该反应为放热反应,放出的热量使脱脂棉剧烈燃烧,
故答案为:放热;
②使用装置Ⅰ证明该反应为放热反应的方法为:在b处接一根导管伸入盛水的水槽里,在试管里进行M与H2O反应实验,观察到水槽中的导管中有气泡冒出,
故答案为:在b处接一根导管伸入盛水的水槽里,在试管里进行M与H2O反应实验,观察到水槽中的导管中有气泡冒出;
③KO2与水反应反应生成氢氧化钾和氧气,KO2中氧元素化合价为-
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:4KO2+2H2O═4KOH+3O2↑.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案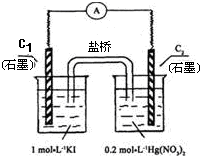 硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )
硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )| A、如图装置的电流方向是从C1到C2 | B、C1是负极,发生的反应是2I-?I2+2e- | C、K+离子向C1电极流动 | D、装置发生的总反应是Hg2++2I-?HgI2↓ |
某化学兴趣小组在做《浓度对化学反应速率的影响》实验时发现,草酸溶液与高锰酸钾溶液反应时,溶液褪色先慢后快。为了探究此反应速率由小变大的原因,甲同学做了如下实验。
(1)0.10mol/L H2C2O4溶液的配制:
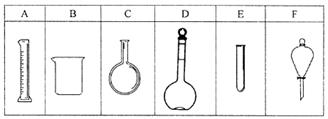
实验室欲配制80mL 0.10mol/L H2C2O4 溶液,需要称取草酸晶体(H2C2O4·2H2O g(精确到0.1g);实验中需要用到的玻璃仪器除了玻璃棒、胶头滴管、量筒外还有: 。(填代号)
(2)反应速率变化的探究
| 1号试管 | 2号试管 | |
| 所加试剂 | 2mL0.10mol/L H2C2O4 溶液, 几滴稀硫酸,4mL0.010mol/L 的KMnO4溶液 | 2mL0.10mol/L H2C2O4 溶液,几 滴稀硫酸,4mL0.010mol/L的 KMnO4溶液,少量MnSO4固体。 |
| 褪色时间 | 31秒 | 4秒 |
①H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为 。
②甲同学能够得出结论 。
(3)在一定条件下,容积为100 L密闭容器中发生反应:CH4(g)+H20(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
 ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
ΔH>0,将1.O molCH4和2.O mol H 20(g)通入该密闭容器,10 min时有O.1 mol CO生成,则10 min内该反应的平均速率ν(H2) 。
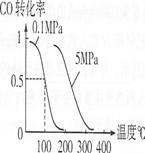
(4)在压强为O.1 MPa条件下,容积为V L某密闭容器中amol CO与2amol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
CH3OH(g);CO的转化率与温度、压强的关系如右图所示。
①该反应的AH O(填“<”、“>”或“=”)。
②100℃时该反应的平衡常数K (用含n、V的代数式表示)。
③在其它条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”),平衡常数 (填“增大”、“减小”或“不变”)。
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.