题目内容
3.已知H2CO3═H++HCO${\;}_{3}^{-}$,K1=4.3×10-7mol•L-1;HCO${\;}_{3}^{-}$═H++CO${\;}_{3}^{2-}$,K2=5.6×10-11mol•L-1;HClO═H++ClO-,K=3.0×10-8mol•L-1.根据上述电离常数分析,下列各式中错误的是( )| A. | Ca(ClO)2+2HCl═CaCl2+2HClO | B. | Ca(ClO)2+2H2O+2CO2═Ca(HCO3)2+2H2O | ||
| C. | NaClO+H2O+CO2═NaHCO3+HClO | D. | Na2CO3+2HClO═2NaClO+H2O+CO2↑ |
分析 已知:H2CO3?H++HCO3-,K1=4.3×10-7;HCO3-?H++CO32-,K2=5.6×10-11;HClO?H++ClO-,K=3.0×10-8,可知碳酸与次氯酸都是弱酸,电离平衡常数越大,酸性越强,所以酸性H2CO3>HClO>HCO3-,结合强酸制弱酸与物质的性质判断.
解答 解:电离平衡常数越大,酸性越强,所以酸性H2CO3>HClO>HCO3-.
A、盐酸是强酸,次氯酸是弱酸,根据强酸制备弱酸,反应可以发生,故A正确;
B、酸性H2CO3>HClO,碳酸钙不能溶于HClO,反应可以发生,故B正确;
C、酸性H2CO3>HClO>HCO3-,根据强酸制备弱酸,反应可以发生,故C正确;
D、酸性H2CO3>HClO>HCO3-,根据强酸制弱酸,次氯酸钠与水、二氧化碳反应应该生成次氯酸与碳酸氢钠,反应为NaClO+H2O+CO2═NaHCO3+HClO,故D错误.
故选D.
点评 本题考查电离平衡常数的运用、复分解反应的反应发生的条件等,难度中等,注意B选项中碳酸钙不溶于次氯酸,所以反应可以进行.

练习册系列答案
相关题目
13.甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一.回答下列问题:
(1)工业上可用CO2和H2反应合成甲醇.已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ/mol-1
CH2OH(g)+$\frac{3}{2}$O2═CO2(g)+2H2O(g) )△H2=-676kJ/mol-1
①写出CO2与H2反应生成CH2OH与H2O(g)的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母).
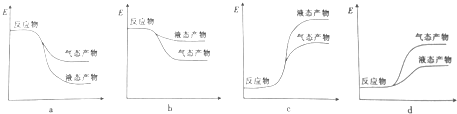
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
①x=0.14,250℃时该反应的平衡常数K=46.3.
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
(3)CH3OH在催化剂条件下可以被直接氧化成HCOOH.在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度HCOOH溶液混合后所得溶液中各离子浓度大小关系为c(Na+)>c(HCOO-)>c(OH-)>c(H+).
(1)工业上可用CO2和H2反应合成甲醇.已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ/mol-1
CH2OH(g)+$\frac{3}{2}$O2═CO2(g)+2H2O(g) )△H2=-676kJ/mol-1
①写出CO2与H2反应生成CH2OH与H2O(g)的热化学方程式:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
②下列表示该合成甲醇反应的能量变化示意图中正确的是a(填字母).

③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•L-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
(3)CH3OH在催化剂条件下可以被直接氧化成HCOOH.在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度HCOOH溶液混合后所得溶液中各离子浓度大小关系为c(Na+)>c(HCOO-)>c(OH-)>c(H+).
14.下列现象及结论均正确的是( )
| 现象 | 结论 | |
| A | 向Na2O2与水反应完的溶液中,滴加石蕊试液,溶液先变蓝后褪色 | Na2O2与水反应后的溶液呈碱性,且有少量的Na2O2剩余,而氧化石蕊使其褪色 |
| B | 将盐酸与NaHCO3反应生成的CO2气体,直接通入Na2SiO3溶液中出现浑浊 | 说明碳的非金属性强于硅 |
| C | Na2S溶液与Na2SO3溶液混合后出现浑浊 | 发生反应的离子方程式为: 2S2-+SO32-+3H2O═3S↓+6OH- |
| D | 用饱和食盐水吸收氯气中混有的HCl气体,出现白色浑浊 | 白色浑浊为析出的氯化钠晶体 |
| A. | A | B. | B | C. | C | D. | D |
11.如表有关实验的解释或结论不正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 某溶液加CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中一定有I2 |
| B | 向样品溶液中先滴加过量的稀盐酸,再滴加BaCl2溶液 | 滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀. | 说明样品溶液中一定含有SO42- |
| C | 向某溶液中加入硝酸银,再加入稀硝酸 | 有白色沉淀 | 原溶液中有Cl- |
| D | 向某溶液中加入稀硫酸 | 生成无色气体 | 说明原溶液中一定有CO32- |
| A. | A | B. | B | C. | C | D. | D |
18.下列叙述正确的是( )
| A. | 分液时,上层液体应从分液漏斗的上口倒出 | |
| B. | 蒸发时,应把蒸发皿中的水蒸干,再熄灭酒精灯 | |
| C. | 稀释时,把水倒人浓硫酸中 | |
| D. | 过滤时,为了加快过滤速度,可用玻璃棒搅拌 |
8.下列各选项中,前者属于电解质,后者属于非电解质的是( )
| A. | NaOH、氯气 | B. | 盐酸、蔗糖 | C. | 熔融NaCl、酒精 | D. | 二氧化碳、BaSO4 |
12.在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,下列结论正确的是( )
| A. | 该反应达到平衡时,放出的热量等于92.4KJ | |
| B. | 达到平衡后向容器中通入1mol氦气,平衡向逆反应方向移动 | |
| C. | 升高温度,反应速率加快,反应放出的热量减小 | |
| D. | 加入催化剂,逆反应速率不变 |
13.下列叙述不正确的是( )
| A. | pH=3的醋酸溶液,稀释10倍后pH<4 | |
| B. | 0.2 mol•L-1的盐酸,与等体积水混合后pH=1 | |
| C. | 100℃时纯水的pH<7,说明加热可以导致纯水呈酸性 | |
| D. | 25℃时,pH=5的盐酸与pH=9的氨水溶液等体积混合后pH>7 |