题目内容
13.下列叙述不正确的是( )| A. | pH=3的醋酸溶液,稀释10倍后pH<4 | |
| B. | 0.2 mol•L-1的盐酸,与等体积水混合后pH=1 | |
| C. | 100℃时纯水的pH<7,说明加热可以导致纯水呈酸性 | |
| D. | 25℃时,pH=5的盐酸与pH=9的氨水溶液等体积混合后pH>7 |
分析 A、醋酸是弱酸,存在电离平衡,加水稀释促进其电离;
B、0.2mol/L的盐酸与等体积的水混合后,其浓度为0.1mol/L;
C、纯水无论温度如何变化始终显中性;
D、pH=5的盐酸与pH=9的氨水,氨水浓度大,等体积混合,氨水过量.
解答 解:A、醋酸溶液中存在电离平衡,加水稀释促进其电离,pH=3的醋酸溶液,稀释10倍后pH<4,故A正确;
B、盐酸是强酸,0.1mol/L的盐酸的pH=1,共B正确;
C、加热促进水的电离,但纯水始终显中性,故C错误;
D、pH=5的盐酸与pH=9的氨水,氨水浓度大,等体积混合,氨水过量,所以混合后溶液的pH>7,故D正确;
故选C.
点评 本题考查酸碱混合溶液的定性分析及pH的计算,为高频考点,把握弱电解质的电离、稀释及酸碱混合后溶液中的溶质等为解答的关键,综合性较强,注重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.已知H2CO3═H++HCO${\;}_{3}^{-}$,K1=4.3×10-7mol•L-1;HCO${\;}_{3}^{-}$═H++CO${\;}_{3}^{2-}$,K2=5.6×10-11mol•L-1;HClO═H++ClO-,K=3.0×10-8mol•L-1.根据上述电离常数分析,下列各式中错误的是( )
| A. | Ca(ClO)2+2HCl═CaCl2+2HClO | B. | Ca(ClO)2+2H2O+2CO2═Ca(HCO3)2+2H2O | ||
| C. | NaClO+H2O+CO2═NaHCO3+HClO | D. | Na2CO3+2HClO═2NaClO+H2O+CO2↑ |
1.下列仪器常用于物质分离的是( )


| A. | ①③⑤ | B. | ①②⑥ | C. | ②④⑤ | D. | ②③⑤ |
8.下列实验结论正确的是( )
| A. | 将某无色气体通入溴水中,溴水颜色褪去,该气体一定是SO2 | |
| B. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+ | |
| C. | 向某溶液中滴加KSCN溶液不变色,滴加氯水后溶液显红色,原溶液中一定含Fe2+ | |
| D. | 向某溶液中加入稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液 |
5. 奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
 奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
奥运会会标是五环旗,假定奥运五环旗中的每一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应.且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )| 选项 | 蓝 | 黑 | 红 | 黄 | 绿 |
| A | SiO2 | Fe SO4溶液 | O2 | NaOH溶液 | Cu |
| B | O2 | 稀H2SO4 | CO2 | Fe | NaOH溶液 |
| C | O2 | 稀H2SO4 | Al(OH)3 | NH3 | NaOH |
| D | Mg | CO2 | KOH溶液 | Al | Fe2O3 |
| A. | A | B. | B | C. | C | D. | D |
 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)?y C(g);△H<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图.请回答下列问题:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:x A(g)+2B(s)?y C(g);△H<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图.请回答下列问题: CH2CH3 B.
CH2CH3 B. 与
与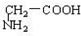 C.
C.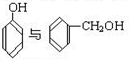 D.CH3CH2C≡CH与CH2=CH-CH=CH2 E.
D.CH3CH2C≡CH与CH2=CH-CH=CH2 E.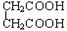 与
与