题目内容
【题目】某学生用0.1000mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
A.取标准NaOH容液注入碱式滴定管至刻度线0以上2cm~3cm;
B.量取25.00mL.待制盐酸溶液注入洁净的锥形瓶,并加儒2~3滴酚酞;
C.用标准溶液润洗滴定管2~3次;
D.调节液面至“0”或“0”以下刻度并记下读数;
E.把盛有标准溶液的碱式滴定管周定好,调节滴定管尖嘴使之充满溶液;
F.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记滴定管液面的刻度。
据此实验光成填空:
(1)正确操作步骤的顺序是__、__、__、__、B、__。(用序号字母填写)
(2)滴定管洗涤之前必须___,滴定过程中时,左手握滴定管的活塞,右手摇动锥形瓶,眼睛注视___,滴定达到终点的标志是___。
(3)上述B步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是___(填“偏大”“偏小”或“不变”)。
(4)若第四次滴定开始和结束时,滴定管中的液面如图所示;则所滴NaOH溶液的体积为___mL。

(5)某学生根据四次实验记录数据计算该盐酸溶液的物质的量浓度:c(HCl)=___。
滴定次数 | 盐酸(mL) | 0.1000mol/LNaOH的体积(mL) | ||
滴定前 | 滴定后 | 溶液体积 | ||
第一次 | 25.00 | 0.05 | 26.17 | 26.12 |
第二次 | 25.00 | 1.58 | 30.31 | 28.73 |
第三次 | 25.00 | 0.22 | 26.30 | 26.08 |
【答案】C A E D F 检查是否漏液 锥形瓶中溶液颜色变化 当滴入最后一滴NaOH容液时,溶液有无色变为浅红色,且半分钟内不褪色 偏大 26.10 0.1044mol/L
【解析】
(1)操作的步骤是选择滴定管,然后洗涤、润洗、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定;
(2)为了防止漏液,滴定管洗涤之前必须检查是否漏液,滴定过程中时,左手握滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,滴定达到终点的标志是当滴入最后一滴NaOH容液时,溶液有无色变为浅红色,且半分钟内不褪色;
(3)根据c(待测)=  判断;
判断;
(4)酸式滴定管中的液面如图所示,起始读数为0.00mL,终点读数为26.10mL,所滴NaOH溶液的体积=终点读数-起始读数为;
(5)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(NaOH),根据c(待测)=  求得答案。
求得答案。
(1)操作的步骤是选择滴定管,然后洗涤、润洗、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定,所以正确的滴定顺序为CA EDBF;
(2)为了防止漏液,滴定管洗涤之前必须检查是否漏液,滴定过程中时,左手握滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色变化,滴定达到终点的标志是当滴入最后一滴NaOH容液时,溶液有无色变为浅红色,且半分钟内不褪色;
(3)锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内的待测液中溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)=  可知,测定结果偏大,故答案为:偏大;
可知,测定结果偏大,故答案为:偏大;
(4)酸式滴定管中的液面如图所示,起始读数为0.00mL,终点读数为26.10mL,所滴NaOH溶液的体积=26.10mL-0.00mL=26.10mL;
(5)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(NaOH)=![]()
mL=26.10mL,根据反应方程式:HCl+NaOH=NaCl+H2O,n(HCl)=n(NaOH),即:0.0261L×0.1000mol/L=0.025L×c(HCl),解得:c(HCl)=![]() =0.1044mol/L,故答案为:0.1044mol/L。
=0.1044mol/L,故答案为:0.1044mol/L。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案【题目】砂质土壤分析中常用 Karl Fischer法是测定其中微量水含量,该方法是利用I2和SO2反应定量消耗水作为原理(假设土壤中其他成分不参加反应),据此回答下列问题:
(1)写出该反应的化学反应方程式:_______________________。
步骤I:反应样品中的水
下图是某同学在实验室模拟Karl Fischer法的实验装置图:
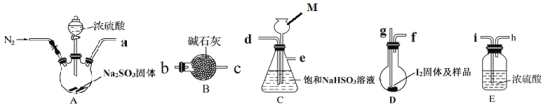
(2)装置连接的顺序为a→____________(填接口字母顺序);M仪器的名称为________________,其在实验过程中的作用是:____________;
(3)操作步骤为:①连接装置并检查装置气密性,②装入药品,____________________;③关闭弹簧夹,打开分液漏斗活塞;④反应结束后,关闭分液漏斗活塞,继续通入N2,⑤取下D装置,···
步骤④中继续通入N2的目的是________________________________
步骤 II:测定剩余的碘
向反应后的D装置加入蒸馏水,过滤,充分洗涤,并合并洗涤液和滤液,将其配成250.00mL溶液,取25.00mL用0.20mol·L-1 Na2S2O3标准液滴定剩余的I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-。
(4)Na2S2O3标准液应装在_____________(填“酸式”、“碱式”)滴定管中;上述操作中,合并洗涤液和滤液的目的是__________________________;
(5)滴定实验重复四次得到数据如下:
实验 | ① | ② | ③ | ④ |
消耗的标准液的体积/mL | 18.37 | 20.05 | 19.95 | 20.00 |
①若实验开始时,向D装置中加入10.00 g土壤样品和10.16克I2(已知I2过量),则样品土壤中水的含量为_________%。
②若Na2S2O3标准液已部分氧化变质,则水含量测定结果将____________(填“偏高”、“ 偏低”或“不变”)。