题目内容
已知强酸与强碱在稀溶液里反应的中和热可表示为:
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,对下列反应:
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ/mol[
H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ/mol
HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-Q3 kJ/mol
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol,对下列反应:
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-Q1 kJ/mol[
H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH=-Q2 kJ/mol
HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH=-Q3 kJ/mol
上述反应均在溶液中进行,则下列Q1、Q2、Q3的关系正确的是
| A.Q2>Q3>Q1 | B.Q2>Q1>Q3 | C.Q1=Q2=Q3 | D.Q2=Q3>Q1 |
A
CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l) 为弱酸与强碱反应,弱酸电离出H+时要吸热热量,所以该反应放出热量较57.3 kJ少;H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l) 反应中,浓硫酸稀释会热,其能量最终释放的最多,即大于57.3 kJ;HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)属于强酸与强碱反应,释放的热量为57.3 kJ;
所以,其关系为:Q2>Q3>Q1 即选项A正确。
所以,其关系为:Q2>Q3>Q1 即选项A正确。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目

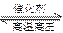 2NH3(g);△H=-92.4kJ·mol-1
2NH3(g);△H=-92.4kJ·mol-1
 目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下:
目前人们处理二氧化碳的方法之一是使其与氢气反应合成甲醇,甲醇是汽车燃料电池的重要燃料。已知氢气、甲醇燃烧的热化学方程式如下: