题目内容
(原创)在遇铝粉能产生大量气体的溶液中,可能大量共存的是
| A.Fe2+、Cl-、NO3-、CH3COO- | B.Na+、Ca2+、Cl-、CO32- |
| C.Na+、SO42-、NH4+、HCO3- | D.Na+、K+、NO3-、CO32- |
D
解析试题分析:离子键如果发生化学反应,则不能大量共存,反之是可以的。在遇铝粉能产生大量气体的溶液中可能显酸性,也可能显碱性。A、如果溶液显碱性,则亚铁离子不能大量共存。如果溶液显酸性,则CH3COO-不能大量共存。另外在酸性条件下NO3-能氧化Fe2+,二者也不能大量共存,A不正确;B、Ca2+与CO32-不能大量共存,B不正确;C、如果溶液显碱性,则HCO3-不能大量共存。如果溶液显碱性,则NH4+、HCO3-均不能大量共存,C不正确;D、如果溶液向酸性,则CO32-不能大量共存。如果溶液显碱性,则四种离子可以大量共存,D正确,答案选D。
考点:考查离子共存的正误判断

练习册系列答案
相关题目
某物质的水溶液能导电,且该物质属于非电解质,溶于水时化学键被破坏的是
| A.液溴 | B.蔗糖 | C.干冰 | D.硫酸钡 |
下列电离方程式,书写错误的是( )
| A.Ca(OH)2=Ca2++2OH- | B.NaHCO3=Na+ + H+ + CO32- |
| C.KHSO4=K++ H+ +SO42- | D.Al2(SO4)3=2Al3++ 3SO42- |
下列离子方程式中,正确的是( )
| A.稀硫酸滴在铁片上:2Fe+6H+=Fe3++3H2↑ |
| B.氢氧化镁与稀盐酸反应:OH?+H+=H2O |
| C.碳酸氢钠溶液与稀盐酸混合:HCO3?+H+=H2O+CO2↑ |
| D.硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH?=Cu(OH)2↓ |
在水溶液中,因发生水解反应而不能大量共存的一组离子是
| A.CO32-、OH-、Na+、H+ | B.Al3+、Na+、AlO2-、Cl- |
| C.Ba2+、HCO3-、K+、SO42- | D.S2-、H+、SO42-、Cu2+ |
下列关于强、弱电解质的叙述,有错误的是
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
向明矾溶液中逐渐滴加Ba(OH)2溶液,可能发生反应的离子方程式为( )
| A.2Al3++3SO42-+3Ba2++6OH—→2Al(OH)3↓ + 3BaSO4↓ |
| B.Al3++SO42-+Ba2++3OH—→ Al(OH)3↓+BaSO4↓ |
| C.2Al3++3SO42-+3Ba2++8OH— → 2 AlO2-+3BaSO4↓+4H2O |
| D.Al3++2SO42-+2Ba2++4OH— → AlO2-+2BaSO4↓+2H2O |
下列物质在水溶液中的电离方程式正确的是( )。
| A.NaHSO4=Na++H++SO42— | B.KClO3=K++Cl5++3O2— |
| C.Ba(OH)2=Ba2++(OH)22— | D.H2SO4=H2++SO42— |
某澄清透明溶液中只可能含有: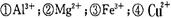
 中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是
中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是
| A.②⑤⑦ | B.②③⑤⑦ | C.③⑤⑦ | D.④⑤⑦ |