题目内容
环境监测测定水中溶解氧的方法是:①量取a mL水样迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好塞子,并振荡摇匀,使之充分反应。②测定:开塞后迅速加入适量硫酸(提供H+)使之生成I2,再用b mol·L-1的Na2S2O3溶液滴定(和I2反应),消耗了V mL(以淀粉为指示剂)Na2S2O3溶液。有关的化学方程式为
2Mn2++O2+4OH-====2MnO(OH)2(该反应极快)
MnO(OH)2+2I-+4H+====Mn2++I2+3H2O
I2+![]() ====2I-+
====2I-+![]()
试回答:
(1)水中溶解氧的量(以g·L-1为单位)的计算式为___________________________。
(2)滴定时(I-和![]() 反应)以淀粉为指示剂,终点时溶液由_______色变为_______色。
反应)以淀粉为指示剂,终点时溶液由_______色变为_______色。
(3)滴定管经水洗和蒸馏水洗涤之后,加滴定剂Na2S2O3,滴定时会导致测定结果_______(填“偏高”“偏低”或“无影响”)。
(4)若打开塞子加硫酸时动作缓慢,测定结果将__________(填“偏高”“偏低”或“无影响”)。
(1)8bV/a (2)蓝 无 (3)偏高 (4)偏高
解析:
本题可由题给化学方程式得出所求水中溶解氧的量的关系式,在确定操作的实验步骤中主要考查滴定管的使用规则和操作方法。
(1)设水中溶解氧的物质的量为x,根据题中给出的三个有关方程式可建立多步计算关系式:
O2—2MnO(OH)2—2I2—![]()
1 mol 4 mol
x b×V×10-3 mol
列式,解得x=0.25bV×10-3 mol。
所以水中溶解氧的量为(0.25bV×10-3)×32/(a×10-3)=8bV/a(g·L-1)
(2)I2和![]() 恰好反应时,I2转化为I-,蓝色褪去,故终点时溶液由蓝色变为无色。
恰好反应时,I2转化为I-,蓝色褪去,故终点时溶液由蓝色变为无色。
(3)滴定管经蒸馏水洗之后,但未用滴定剂Na2S2O3溶液润洗,使装入的Na2S2O3因稀释浓度变小,滴定时,因滴定一定量的I2必须消耗更多的Na2S2O3溶液,亦即V值增大,由(1)的计算式知结果会偏高。
(4)若开塞时间过长,空气中的氧气进入而参与反应,V值增大,其结果偏高。

 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案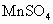 及含有NaOH的KI溶液,塞好塞子,振荡使反应均匀后,开塞,迅速加入硫酸,此时有碘生成,用浓度为bmol·
及含有NaOH的KI溶液,塞好塞子,振荡使反应均匀后,开塞,迅速加入硫酸,此时有碘生成,用浓度为bmol·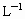 的
的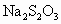 溶液和碘反应,消耗Vml(用淀粉作指示剂).上述过程的反应为:
溶液和碘反应,消耗Vml(用淀粉作指示剂).上述过程的反应为: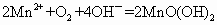
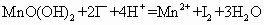
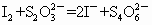
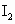 和
和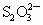 的反应达到反应终点时,溶液颜色变化情况是________.
的反应达到反应终点时,溶液颜色变化情况是________.