题目内容
设NA为阿伏伽德罗常数的数值,则下列说法中,正确的是
A.常温下,0.1mol碳酸钠晶体中含有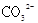 的个数为0.1NA 的个数为0.1NA |
| B.标准状况下,11.2L苯含有C-H键数目为3NA |
| C.常温常压下,54 g重水(D2O)含水分子数为3NA |
| D.将NA个Cl2分子通入足量的水中,所转移的电子总数为NA |
A
试题分析:苯为液体,不适用于标准状况的气体摩尔体积,B错误;D2O的相对分子质量为20,54 g D2O的物质的量为2.7 mol,C错误;Cl2与H2O的反应为可逆反应,故NA个Cl2分子通入足量的水中,转移的电子总数小于NA,D错误。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目

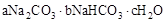 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
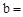
 NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl