题目内容
天然碱的组成可以用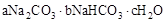 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
将质量为31.0 g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 2.24 L(标准状况)和水5.4 g。
(1)天然碱A的化学式中: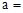
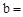
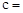
已知:Na2CO3与稀盐酸的反应分下列两步进行:
Na2CO3+HCl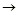 NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl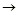 NaCl+CO2↑+H2O
NaCl+CO2↑+H2O
将质量为12.45 g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐
酸的体积(标准状况)的关系如下表所示:
(2)由表中数据可推测加入50mL盐酸时,产生气体的体积为 mL(标准状况);盐酸的浓度为 mol/L;天然碱B的化学式为: 。
(3)若取一定质量的天然碱B加入到30mL该浓度的盐酸中,请写出产生气体体积V(mL,标准状况)与天然碱B质量W(g) 之间的关系式。
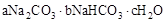 (a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。
(a、b、c为整数)表示。现有A、B两种不同的天然碱样品,分别进行如下实验以确定其化学式。将质量为31.0 g的天然碱A于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2 2.24 L(标准状况)和水5.4 g。
(1)天然碱A的化学式中:
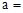
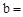
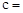
已知:Na2CO3与稀盐酸的反应分下列两步进行:
Na2CO3+HCl
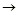 NaCl+NaHCO3 NaHCO3+HCl
NaCl+NaHCO3 NaHCO3+HCl NaCl+CO2↑+H2O
NaCl+CO2↑+H2O将质量为12.45 g的天然碱B溶于水,逐滴滴加某浓度的稀盐酸,产生气体的体积与加入盐
酸的体积(标准状况)的关系如下表所示:
| 盐酸体积(mL) | 20 | 40 | 60 | 80 |
| 产生气体体积(mL) | 0 | 560 | 1680 | 2520 |
(2)由表中数据可推测加入50mL盐酸时,产生气体的体积为 mL(标准状况);盐酸的浓度为 mol/L;天然碱B的化学式为: 。
(3)若取一定质量的天然碱B加入到30mL该浓度的盐酸中,请写出产生气体体积V(mL,标准状况)与天然碱B质量W(g) 之间的关系式。
(1)a=1,b=2,c="2" (各1分,共3分)
(2)1120mL(2分) ; 2.5mol/L (2分) ;2Na2CO3·NaHCO3 ·2H2O (3分)
(3)0g<W≤4.98g V="67200W/332" mL(或V=202.41WmL)
4.78g<W<12.45g V=1680﹣44800W/332 mL (或V=1680﹣134.94W mL)
W≥12.45g V=0mL
(2)1120mL(2分) ; 2.5mol/L (2分) ;2Na2CO3·NaHCO3 ·2H2O (3分)
(3)0g<W≤4.98g V="67200W/332" mL(或V=202.41WmL)
4.78g<W<12.45g V=1680﹣44800W/332 mL (或V=1680﹣134.94W mL)
W≥12.45g V=0mL
试题分析:(1)利用2NaHCO3
 Na2CO3+CO2↑+H2O 这个原理。由题意可知n(CO2)=0.1 mol。
Na2CO3+CO2↑+H2O 这个原理。由题意可知n(CO2)=0.1 mol。2NaHCO3
 Na2CO3+ CO2↑+ H2O
Na2CO3+ CO2↑+ H2O2 1 1 1
0.2 mol 0.1 mol 0.1 mol 0.1 mol
m(NaHCO3)="0.2" mol×84 g·mol-1="16.8" g,所以晶体中
 ,m(H2O)="0.2" mol×18 g·mol-1="3.6" g,m(Na2CO3)=31 g-16.8 g-3.6 g=10.6 g,
,m(H2O)="0.2" mol×18 g·mol-1="3.6" g,m(Na2CO3)=31 g-16.8 g-3.6 g=10.6 g, 。由此可知晶体中n(Na2CO3)∶n(NaHCO3)∶n(H2O)=0.1 mol∶0.2 mol∶0.2 mol=1∶2∶2。所以晶体化学式为Na2CO3·2NaHCO3·2H2O。
。由此可知晶体中n(Na2CO3)∶n(NaHCO3)∶n(H2O)=0.1 mol∶0.2 mol∶0.2 mol=1∶2∶2。所以晶体化学式为Na2CO3·2NaHCO3·2H2O。(2)①Na2CO3与盐酸反应分步进行。首先发生:Na2CO3+HCl="NaCl+" NaHCO3.当Na2CO3完全转化为NaHCO3后,发生NaHCO3+HCl=NaCl+H2O+CO2↑。若固体只含有Na2CO3,则前后两步消耗的盐酸物质的量相等。由56题由40到60ml当盐酸体积增大了20ml时气体体积增加了1120ml,故加入50mL盐酸时,盐酸体积增加了10ml时,产生气体的体积就增加了560ml,即为1120ml。由表中数据当盐酸体积由60到80ml增加20ml时,气体的体积只增加了840ml,说明此时盐酸过量,12.45克B完全反应完。可以求出n(CO2)=2520/22.4=0.1125mol,再由20ml盐酸产生气体1120ml,即为0.5mol,此时发生的反应为NaHCO3+HCl=NaCl+H2O+CO2↑,可知盐酸的物质的量为0.5mol,则浓度为0.5/0.02= 2.5mol/L。由数据盐酸体积40ml对应气体体积560ml,进行分析,盐酸不中,固体剩余。n(HCl)=0.1 mol,B中碳酸钠物质的量为x,则碳酸氢钠为0.1125-x,和碳酸钠反应掉的盐酸为xmol,和碳酸氢钠反应的盐酸为0.1-x,则有0.1-x="0.025" x=0.075mol,即碳酸钠质量为0.075*106=7.95g,碳酸氢钠为0.1125-x=0.1125-0.075=0.0375mol,质量为3.15g,水的质量为1.35g,物质的量为0.075mol。n(Na2CO3)∶n(NaHCO3)∶n(H2O)=0.075mol∶0.0375 mol∶0.075mol=2∶1∶2。
(3)当盐酸与天然碱恰好完全反应生成CO2时,天然碱2Na2CO3?NaHCO3?2H2O的摩尔质量为332g?mol-1,每摩尔天然碱消耗盐酸5mol,则样品质量为:(0.03×2.5×332)/5g=4.98g;当样品过量,Na2CO3恰好转化为NaHCO3而没有生成CO2时,样品质量为:(0.03×2.5×332)/2g=12.45g。然后在0<m≤4.98、4.98<m≤12.45、1245≤m三个区间讨论计算即可。

练习册系列答案
相关题目
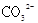 的个数为0.1NA
的个数为0.1NA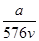 mol·L-1
mol·L-1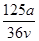 mol·L-1
mol·L-1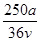 mol·L-1
mol·L-1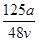 mol·L-1
mol·L-1