题目内容
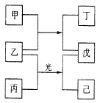
【题目】短周期元素X、Y、Z、W的原子序数依次增加。甲、丙、戊是由这些元素组成的二元化合物。乙是元素W的单质,通常为黄绿色气体,丁的水溶液具有漂白性,0.01mol/L戊溶液的pH为2,己通常是难溶于水的混合物。上述物质的转化关系如图所示。回答下列问题:
(1)写出化合物丁的结构式__。
(2)X、Z元素可形成原子个数比为1∶1的化合物,它的电子式为___。
(3)X、Y元素组成的某化合物分子中含18个电子。10g该化合物在空气充分燃烧生成稳定的氧化物放出的热量为QkJ,写出表示该物质燃烧热的热化学方程式___。
(4)Z、W两种元素组成的化合物WZ2的用途有___。
【答案】H—O—Cl ![]() C2H6(g)+
C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) ΔH=-3Q kJ·mol-1 杀菌消毒、漂白
O2(g)=2CO2(g)+3H2O(l) ΔH=-3Q kJ·mol-1 杀菌消毒、漂白
【解析】
短周期元素X、Y、Z、W的原子序数依次增加,甲、丙、戊是由这些元素组成的二元化合物。乙是黄绿色气体,故乙是Cl2,W是Cl;丁的水溶液具有漂白性,故丁含有ClO-,0.01mol/L戊溶液的pH为2,故戊是一元强酸,又因为反应物中含有Cl,所以戊是HCl,甲是H2O,丁是HClO;Cl2在光照条件下反应,故丙中含有C、H两种元素,所以X是H、Y是C、Z是O、W是Cl。
由上述分析可知,X是H、Y是C、Z是O、W是Cl:
(1)由上述分析可知,丁是HClO,HClO分子的中心原子是O原子,结构式是H—O—Cl;
(2)X是H、Z是O,X、Z元素可形成原子个数比为1∶1的化合物是H2O2,其电子式是
![]() ;
;
(3)X是H、Y是C,X、Y元素组成的化合物分子中含18个电子,该物质是C2H6,10g C2H6的物质的量是![]() =
=![]() ,因为10g C2H6在空气充分燃烧生成稳定的氧化物放出的热量为QkJ,故 1mol C2H6在空气充分燃烧生成稳定的氧化物放出的热量为3QkJ,C2H6燃烧热的热化学方程式为:C2H6(g)+
,因为10g C2H6在空气充分燃烧生成稳定的氧化物放出的热量为QkJ,故 1mol C2H6在空气充分燃烧生成稳定的氧化物放出的热量为3QkJ,C2H6燃烧热的热化学方程式为:C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) ΔH=-3Q kJ·mol-1;
O2(g)=2CO2(g)+3H2O(l) ΔH=-3Q kJ·mol-1;
(4)Z是O、W是Cl,Z、W两种元素组成的化合物WZ2是ClO2,ClO2的用途:杀菌消毒、漂白等。

 优学名师名题系列答案
优学名师名题系列答案【题目】科学家研究出一种以天然气为燃料的“燃烧前捕获系统”,其简单流程如图所示(条件及物质未标出)。

(1)已知:CH4、CO、H2的燃烧热分别为890.3 kJ·mol-1、283.0 kJ·mol-1、285.8 kJ·mol-1,则上述流程中第一步反应2CH4(g)+O2(g)===2CO(g)+4H2(g)的ΔH=______________。
(2)工业上可用H2和CO2制备甲醇,其反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
CH3OH(g)+H2O(g),某温度下,将1 mol CO2和3 mol H2充入体积不变的2 L密闭容器中,发生上述反应,测得不同时刻反应前后的压强关系如下表:
时间/h | 1 | 2 | 3 | 4 | 5 | 6 |
| 0.90 | 0.85 | 0.83 | 0.81 | 0.80 | 0.80 |
①用H2表示前2 h 的平均反应速率v(H2)=_________________________________;
②该温度下,CO2的平衡转化率为________。
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生(2)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)CO2经催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。
C2H4(g)+4H2O(g) ΔH。在0.1 MPa时,按n(CO2)∶n(H2)=1∶3投料,如图所示为不同温度(T)下,平衡时四种气态物质的物质的量(n)关系。

①该反应的ΔH________0(填“>”或“<”)。
②曲线c表示的物质为_______。
③为提高H2的平衡转化率,除改变温度外,还可采取的措施______________。(答出一条即可)