题目内容
标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是 ( )
![]() A.H2S、SO2 B.O2 C.H2S D.SO3
A.H2S、SO2 B.O2 C.H2S D.SO3
C
![]()
解析:
H2S和O2反应后的气体产物可能为①H2S;②SO2;③SO2和O2。
![]() 如为情况①,说明H2S过量。
如为情况①,说明H2S过量。
![]() 则由:2H2S+O2=2H2O+2S体积减少
则由:2H2S+O2=2H2O+2S体积减少
![]() 2 1 3
2 1 3
![]() 60 30 100-10=90
60 30 100-10=90
![]() 参加反应的H2S和O2的总体积为60+30=90,则余下的10mL气体为H2S。
参加反应的H2S和O2的总体积为60+30=90,则余下的10mL气体为H2S。
![]() 若为情况②或③,说明O2过量。
若为情况②或③,说明O2过量。
![]()
![]() 则由:2H2S+3O2=2H2O+2SO2体积减少
则由:2H2S+3O2=2H2O+2SO2体积减少
![]() 2 3 2 3
2 3 2 3
![]() 60 90 90
60 90 90
![]() 则参加反应的H2S和O2的总体积为60+90=150>100,所以这两种情况不存在。
则参加反应的H2S和O2的总体积为60+90=150>100,所以这两种情况不存在。

练习册系列答案
相关题目
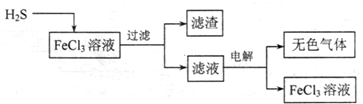
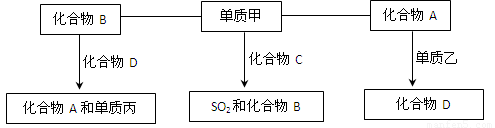
 。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。
。CO2和过氧化钠反应的方程式为2CO2+2Na2O2=2Na2CO3+O2↑,在反应中过氧化钠既是氧化剂也是还原剂,转移的电子是2,所以当消耗1.25mol是转移的电子数目为1.25NA。