题目内容
 A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最 小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周 期;E元素原子的最外层电子数是其次外层电子数的
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最 小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周 期;E元素原子的最外层电子数是其次外层电子数的| 3 | 4 |
请回答下列问题:
(1)B单质的电子式是
A.比较这两种元素的常见单质是沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(4)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol液态B2A4和足量液 态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量.试写出该反应的热化学方程式
②B2A4是一种可燃性液体,B2A4--空气燃料电池是一种碱性燃料电池,电解质溶液是 20%-30%的KOH溶液,该电池放电时的负极反应式为:
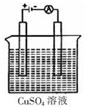
③图是一个电解装置示意图,假设使用B2A4-空气燃料电池作为本装置中的电源,通电前两极铜片的质量相等,通电一段 时间后两极铜片的质量相差12.8g,则通过电路的电子的物质的量为
分析:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A是H元素;
B元素的最高价氧化物对应水化物与其氢化物能生成盐,B为N元素;
D与A同主族,且与E同周期,D为短周期元素,D的原子序数大于B,所以D是Na元素;
E元素原子的最外层电子数是其次外层电子数的
,且E是短周期元素,E为S元素;
A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C是O元素,结合物质的结构和性质分析解答.
B元素的最高价氧化物对应水化物与其氢化物能生成盐,B为N元素;
D与A同主族,且与E同周期,D为短周期元素,D的原子序数大于B,所以D是Na元素;
E元素原子的最外层电子数是其次外层电子数的
| 3 |
| 4 |
A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C是O元素,结合物质的结构和性质分析解答.
解答:解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,则A是H元素;
B元素的最高价氧化物对应水化物与其氢化物能生成盐,B为N元素;
D与A同主族,且与E同周期,D为短周期元素,D的原子序数大于B,所以D是Na元素;
E元素原子的最外层电子数是其次外层电子数的
,且E是短周期元素,E为S元素;
A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C是O元素,
(1)B的单质是氮气,氮原子之间共用3个电子对,所以其电子式为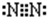 ,氧与硫同主族,从上到下非金属性在减弱,则非金属性O>S,可以利用与氢气化合的难易程度及气态氢化物的稳定性、单质的氧化性、氢化物的稳定性来判断,故BC正确,
,氧与硫同主族,从上到下非金属性在减弱,则非金属性O>S,可以利用与氢气化合的难易程度及气态氢化物的稳定性、单质的氧化性、氢化物的稳定性来判断,故BC正确,
故答案为: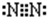 ;BC;
;BC;
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成)亚硫酸氢钠、硫酸氢钠,两种酸式盐相互反应生成二氧化硫和水,其离子方程式为HSO3-+H+═SO2↑+H2O,
故答案为:HSO3-+H+═SO2↑+H2O;
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,甲为HS-,乙为OH-,二者反应生成硫离子和水,则甲与乙反应的离子方程式HS-+OH-═S2-+H2O,
故答案为:HS-+OH-═S2-+H2O;
(4)0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量,则1mol液态N2H4和足量液态H2O2反应放出的热量=
×1mol=641.5kJ,所以其热化学反应方程式为:N2H4 (l)+2 H2O2+(l)=N2(g)+4H2O (g)△H=-641.5 kJ/mol,
故答案为:N2H4 (l)+2 H2O2+(l)=N2(g)+4H2O (g)△H=-641.5 kJ/mol;
②该原电池负极上N2H4失电子和氢氧根离子反应生成氮气和水,所以其电极反应式为:N2H4-4eˉ+4OHˉ=N2+4H2O,故答案为:N2H4-4eˉ+4OHˉ=N2+4H2O;
③用铜作电极电解硫酸铜溶液时,阳极上铜失电子生成铜离子,阴极上铜离子得电子生成铜,所以两极质量差=阳极减少的质量+阴极增加的质量,通电一段时间后两极铜片的质量相差12.8g,则阴极上析出铜的质量为
=6.4g,阴极上电极反应式为Cu2++2e-=Cu,则通过电路的电子的物质的量=
×2=0.2mol,
故答案为:0.2mol.
B元素的最高价氧化物对应水化物与其氢化物能生成盐,B为N元素;
D与A同主族,且与E同周期,D为短周期元素,D的原子序数大于B,所以D是Na元素;
E元素原子的最外层电子数是其次外层电子数的
| 3 |
| 4 |
A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物,则C是O元素,
(1)B的单质是氮气,氮原子之间共用3个电子对,所以其电子式为
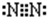 ,氧与硫同主族,从上到下非金属性在减弱,则非金属性O>S,可以利用与氢气化合的难易程度及气态氢化物的稳定性、单质的氧化性、氢化物的稳定性来判断,故BC正确,
,氧与硫同主族,从上到下非金属性在减弱,则非金属性O>S,可以利用与氢气化合的难易程度及气态氢化物的稳定性、单质的氧化性、氢化物的稳定性来判断,故BC正确,故答案为:
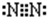 ;BC;
;BC;(2)A、B、C、E可形成两种酸式盐(均由四种元素组成)亚硫酸氢钠、硫酸氢钠,两种酸式盐相互反应生成二氧化硫和水,其离子方程式为HSO3-+H+═SO2↑+H2O,
故答案为:HSO3-+H+═SO2↑+H2O;
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,甲为HS-,乙为OH-,二者反应生成硫离子和水,则甲与乙反应的离子方程式HS-+OH-═S2-+H2O,
故答案为:HS-+OH-═S2-+H2O;
(4)0.4mol液态N2H4和足量液态H2O2反应,生成气态N2和气态H2O,放出256.6kJ的热量,则1mol液态N2H4和足量液态H2O2反应放出的热量=
| 256.6kJ |
| 0.4mol |
故答案为:N2H4 (l)+2 H2O2+(l)=N2(g)+4H2O (g)△H=-641.5 kJ/mol;
②该原电池负极上N2H4失电子和氢氧根离子反应生成氮气和水,所以其电极反应式为:N2H4-4eˉ+4OHˉ=N2+4H2O,故答案为:N2H4-4eˉ+4OHˉ=N2+4H2O;
③用铜作电极电解硫酸铜溶液时,阳极上铜失电子生成铜离子,阴极上铜离子得电子生成铜,所以两极质量差=阳极减少的质量+阴极增加的质量,通电一段时间后两极铜片的质量相差12.8g,则阴极上析出铜的质量为
| 12.8g |
| 2 |
| 6.4g |
| 64g/mol |
故答案为:0.2mol.
点评:本题考查了元素位置、结构和性质的关系,涉及离子方程式的书写、原电池和电解池原理、热化学反应等知识点,这些都是考试热点,正确推断元素是解本题关键,同时考查学生分析问题、解决问题的能力,难度中等.

练习册系列答案
相关题目




 元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )
元素周期表短周期的一部分如表所示.下列有关A、B、C、D、E五种元素的叙述中,正确的是( )