题目内容
将5.00g氯化钠、溴化钠和氯化钙的混和物溶于水,通入足量Cl2充分反应,然后把溶液蒸干并灼烧(高温加热),灼烧后残留物的质量为4.911g.若将此残留物再溶于水加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为0.270g.求混和物中各化合物的质量分数.
解:设混和物中NaCl质量为x,NaBr质量为y,CaCl2质量为z.
则x+y+z=5g
通入足量Cl2充分反应,然后把溶液蒸干并灼烧,发生反应为2NaBr+Cl2═2NaCl+Br2,固体质量变化为NaBr生成NaCl的变化,利用差量法计算,
2NaBr+Cl2═2NaCl+Br2 固体质量减少
2×103 2×58.5 (103g-58.5g)×2=89g
y (5g-4.914g)=0.086g
y=0.2g
NaBr%= ×100%=4%,
×100%=4%,
将此残留物再溶于水加入足量的碳酸钠溶液,所得的沉淀为碳酸钙,根据氯化钙与碳酸钠反应方程式计算,
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
z 0.270g
z=0.3g
CaCl2%= ×100%=6%,
×100%=6%,
x=5g-O.2 g-0.3 g=4.5g,
NaCl%=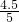 ×100=90%,
×100=90%,
答:NaBr的质量分数为4%,CaCl2的质量分数为6%,NaCl的质量分数为90%.
分析:根据通入足量Cl2充分反应,然后把溶液蒸干并灼烧,发生反应为2NaBr+Cl2═2NaCl+Br2,固体质量变化为NaBr生成NaCl的变化,利用差量法计算NaBr的质量,根据将此残留物再溶于水加入足量的碳酸钠溶液,所得的沉淀为碳酸钙,根据氯化钙与碳酸钠反应方程式计算氯化钙的质量,根据总质量减去溴化钠和氯化钙的质量即得氯化钠的质量,则可分别计算质量分数.
点评:本题考查混合物的计算,题目难度较大,本题根据利用差量法计算NaBr的质量,利用方程式计算氯化钙的质量.
则x+y+z=5g
通入足量Cl2充分反应,然后把溶液蒸干并灼烧,发生反应为2NaBr+Cl2═2NaCl+Br2,固体质量变化为NaBr生成NaCl的变化,利用差量法计算,
2NaBr+Cl2═2NaCl+Br2 固体质量减少
2×103 2×58.5 (103g-58.5g)×2=89g
y (5g-4.914g)=0.086g
y=0.2g
NaBr%=
 ×100%=4%,
×100%=4%,将此残留物再溶于水加入足量的碳酸钠溶液,所得的沉淀为碳酸钙,根据氯化钙与碳酸钠反应方程式计算,
CaCl2+Na2CO3═CaCO3↓+2NaCl
111 100
z 0.270g
z=0.3g
CaCl2%=
 ×100%=6%,
×100%=6%,x=5g-O.2 g-0.3 g=4.5g,
NaCl%=
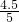 ×100=90%,
×100=90%,答:NaBr的质量分数为4%,CaCl2的质量分数为6%,NaCl的质量分数为90%.
分析:根据通入足量Cl2充分反应,然后把溶液蒸干并灼烧,发生反应为2NaBr+Cl2═2NaCl+Br2,固体质量变化为NaBr生成NaCl的变化,利用差量法计算NaBr的质量,根据将此残留物再溶于水加入足量的碳酸钠溶液,所得的沉淀为碳酸钙,根据氯化钙与碳酸钠反应方程式计算氯化钙的质量,根据总质量减去溴化钠和氯化钙的质量即得氯化钠的质量,则可分别计算质量分数.
点评:本题考查混合物的计算,题目难度较大,本题根据利用差量法计算NaBr的质量,利用方程式计算氯化钙的质量.

练习册系列答案
相关题目