题目内容
氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳。若有1%的NaOH转变为 Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂,盐酸浓度的测定结果会( )。
| A.偏低l% | B.偏高1% | C.无影响 | D.偏高0.1% |
C
因为不论是氢氧化钠还是碳酸钠和盐酸反应的最终产物都是氯化钠,虽然碳酸钠还生成二氧化碳,但由于甲基橙的变色范围是3.1~4.4,所以根据钠离子守恒可知,消耗的盐酸是相同的,因此对测定结果是无影响的。答案选C

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
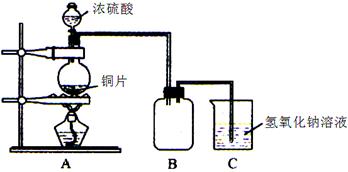

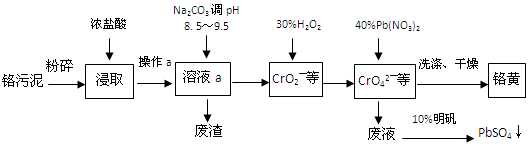
 Al(OH)3 +3H+的平衡常数为 。
Al(OH)3 +3H+的平衡常数为 。
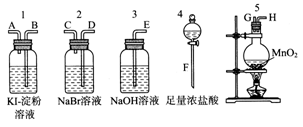
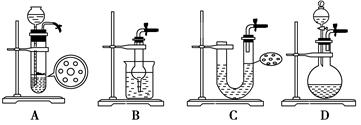

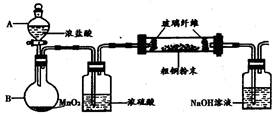
 CuCl42-(aq)+4H2O(l)
CuCl42-(aq)+4H2O(l)