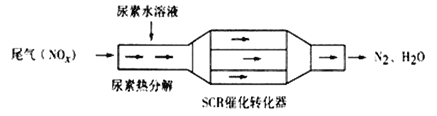
题目内容
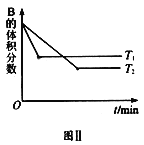
【题目】T ℃时,将5mol A和7mol B气体通入体积为10L的密闭容器中(容积不变),反应过程中A、B、C的浓度变化如图Ⅰ所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间关系如图Ⅱ所示:
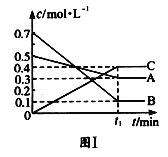
则下列结论正确的是( )
A.T ℃时,将4mol A、4mol B和2mol C气体通入体积为10L的密闭容器中(容积不变),达到平衡时,C的浓度为0.4 mol·L-1
B.保持其他条件不变,在(t1+10)min 时,加入催化剂,平衡向正反应方向移动
C.保持其他条件不变,在(t1+10)min 时,通入稀有气体,平衡向逆反应方向移动
D.保持其他条件不变,升高温度,正、逆反应速率均增大,A的转化率也增大
【答案】A
【解析】
反应达到平衡状态时,A浓度的变化量=(0.50.3)mol/L=0.2mol/L,B浓度的变化量=(0.70.1)mol/L=0.6mol/L,C浓度的变化量=(0.40)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)2C(g),根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应。
A. 根据图I知,化学平衡常数K=(0.4)2/0.3×(0.1)3,
假设C的平衡浓度是0.4mol/L,
A(g)+3B(g)2C(g),
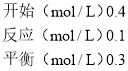
![]()
![]()
化学平衡常数K′=(0.4)2/0.3×(0.1)3,所以符合平衡常数K,故A正确;
B. 因为催化剂只改变反应速率,不改变平衡移动,所以在(t1+10)min时,加入催化剂,平衡不移动,故B错误;
C. 密闭容器中,通入稀有气体,各物质的浓度不变,平衡不移动,所以在(t1+10)min时,通入稀有气体,平衡不移动,故C错误;
D. 其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图II知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故D错误;
故选A

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案【题目】某同学用滤纸折成一个纸蝴蝶,并喷洒一种溶液(保持湿润),挂在铁架台上,将盛某种溶液的烧杯放在纸蝴蝶的下方,如图所示。向烧杯中加入另一种物质,过一会儿发现纸蝴蝶变为红色且保持红色不变,下面的组合能够实现上述变化的是( )
A | B | C | D | |
纸蝴蝶上的喷洒液 | 石蕊 | 酚酞 | 酚酞 | 石蕊 |
烧杯中的溶液 | 浓硫酸 | 氯化铵 | 稀硫酸 | 高锰酸钾 |
加入烧杯中的物质 | 铜 | 氢氧化钠浓溶液 | 氨水 | 浓盐酸 |
A.AB.BC.CD.D
【题目】德国化学家哈伯(F. Haber, 1868-1930)发明的合成氨技术使大气中的氮气变成了生产氮肥的永不枯竭的廉价来源,从而使农业生产依赖土壤的程度减弱,解决了地球上因粮食不足导致的饥饿和死亡问题。因此这位解救世界粮食危机的化学天才获得了1918年诺贝尔化学奖。现在我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。
查阅资料,获得以下键能数据:
化学键 | N≡N | H-H | N-H |
键能/(kJ/mol) | 946 | 436 | 391 |
(1)计算工业合成氨反应的反应热:N2(g)+3H2(g)2NH3(g)△H=________kJ/mol
(2)一定温度下,向一个恒压容器中充入N20.6mol,H20.5mol,在一定温度下进行反应:N2(g)+3H2(g) 2NH3(g),达到平衡时,N2的转化率为![]() ,此时容器的体积为1L。
,此时容器的体积为1L。
该温度时容器中平衡体系的平衡常数是______________。
(3)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法K2CO3溶液再生,其装置如图所示:
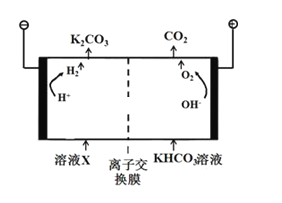
①在阳极区发生的反应包括____________________和H++HCO3- ═H2O+CO2↑。
②简述CO32-在阴极区再生的原理__________。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
2H2(g)+ O2(g)═2H2O(g) Δ H1═-484kJ/mol
2CH3OH(g)+ 3O2(g)═2CO2(g)+4H2O(g) Δ H2═-1352kJ/mol
写出CO2和H2生成CH3OH(g)和H2O(g)的热化学方程式__________。