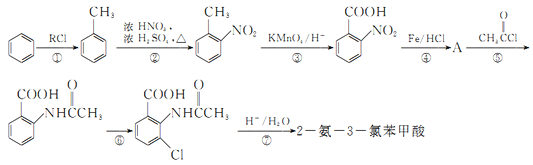
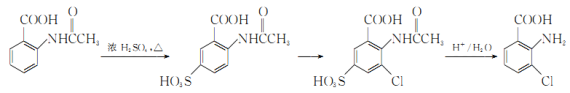题目内容
【题目】将Fe3+ +Ag ![]() Fe2+ +Ag+ (K=1.8)设计成下图所示原电池(盐桥中装有琼脂——KNO3溶液)。在本题中灵敏电流计指针偏转方向即电子流动方向。
Fe2+ +Ag+ (K=1.8)设计成下图所示原电池(盐桥中装有琼脂——KNO3溶液)。在本题中灵敏电流计指针偏转方向即电子流动方向。
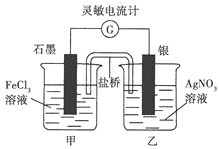
开始接通导线时灵敏电流计指针向左偏转,一段时间后电流计指针指向中间“0”刻度。然后进行如下实验:
(1)向A烧杯中滴加浓FeCl3溶液,指针___(填“向左”、“向右”或“不偏转”);
(2)向B烧杯中滴加少量Na2S溶液,指针__(填“向左”、“向右”或“不偏转”),原因为___。
(3)下图所示原电池的负极是_____,负极的电极反应式是____________,写出该反应的离子方程式________________________,该反应的平衡常数等于____________。(Ksp(AgCl)=1.8×10-10)

【答案】向左 向左 B烧杯中Ag+和S2-反应生成Ag2S沉淀,Ag+浓度减小,平衡正向进行,银被氧化做负极 银 Ag- e-+Cl- = AgCl Ag+Fe3+ +Cl- = AgCl+Fe2+ 1010
【解析】
由题给信息开始接通导线时灵敏电流计指针向左偏转,结合原电池反应原理可知,石墨电极为正极,Fe3+在正极上得电子,发生还原反应,银电极为负极,Ag失电子,发生氧化反应,外电路中电子从银电极流向石墨电极;一段时间后电流计指针指向中间“0”,说明原电池反应结束。
(1)向A烧杯中滴加浓FeCl3溶液,增大溶液中Fe3+浓度,平衡正向进行,银被氧化做负极,灵敏电流计指针向左偏转,故答案为:向左;
(2)向B烧杯中滴加少量Na2S溶液,烧杯中Ag+和S2-反应生成Ag2S沉淀,Ag+浓度减小,平衡正向进行,银被氧化做负极,灵敏电流计指针向左偏转,故答案为:向左;
(3)由题给装置可知,Fe3+在正极上得电子,发生还原反应,银电极为负极,Ag失电子,发生氧化反应,电极反应式为Ag- e-+Cl- = AgCl,该反应的离子方程式为Ag+Fe3+ +Cl- = AgCl+Fe2+,反应的平衡常数K/=c(Fe2+)/[c(Fe3+)c(Cl-)]=c(Ag+)c(Fe2+)/[c(Fe3+)×c(Ag+) c(Cl-)]=K/ Ksp(AgCl)=1.8/(1.8×10-10)=1.0×1010,故答案为:Ag- e-+Cl- = AgCl;Ag+Fe3+ +Cl- = AgCl+Fe2+;1010。

 阅读快车系列答案
阅读快车系列答案