题目内容
【题目】高铁电池是一种新型电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述正确的是( )
A. 放电时正极附近溶液的碱性增强
B. 放电时每转移3mol电子,正极有1mol K2FeO4被氧化
C. 放电时正极反应为:Zn﹣2e-+2OH-═Zn(OH)2
D. 该原电池,Zn作正极,可用石墨等作负极
【答案】A
【解析】A、根据电池总反应,正极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,生成OH-,c(OH-)增大,正极附近溶液的碱性增强,故A正确;B、根据A选项的分析,转移3mol电子,有1molK2FeO4被还原,故B错误;C、锌的化合价升高,应在负极上参加反应,即负极反应式为Zn-2e-+2OH-=Zn(OH)2,故C错误;D、锌作负极,故D错误。

 阅读快车系列答案
阅读快车系列答案【题目】(1)化学反应速率是描述化学反应进行快慢程度的物理量。如图是某同学利用稀硫酸和硫代硫酸钠(Na2S2O3)的反应来测定化学反应速率并探究其影响因素的实验。
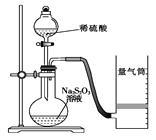
Ⅰ.测定化学反应速率:已知:S2O![]() +2H+ === H2O+S↓+SO2↑
+2H+ === H2O+S↓+SO2↑
① 除如图装置所示的实验用品外,还需要的一件实验用品是__________。
② 若在2 min时收集到224 mL(标准状况下)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是_____________________。
③ 利用该化学反应,试简述一种测定反应速率的其他方法:_______________。
Ⅱ.探究化学反应速率的影响因素:已知 I2+2S2O32- === S4O62- +2I-
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知Na2S2O3溶液足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | V | t3 |
④ 表中V =__________mL,t1、t2、t3的大小关系是____________________________。
( 2 ) 恒温条件下,在体积固定的密闭容器中,发生反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1。
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1。
请回答下列问题:
① c1+c2+c3的取值范围为____________________
② c1:c2的值为__________________ ③下列叙述能证明该反应已达到化学平衡状态的是 __________ A.混合气体密度不再变化 B.v正(X)=2 v逆(Z) C.容器内压强不再发生变化 D.混合气体的平均相对分子质量 E. X的物质的量和Y的物质的量之比