题目内容
【题目】某微粒的结构示意图为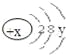 试回答:
试回答:
(1)当x﹣y=10时,该粒子为 (填“原子”或“阳离子”“阴离子”)
(2)当y=8时,该粒子可能是(任写三种): 、 、 .
(3)写出y=3的元素最高价氧化物与y=6的元素最高价氧化物对应水化物发生反应,反应后所得溶液主要阳离子的结构示意图 .
【答案】(1)原子;
(2)K+;Cl﹣;Ar;
(3) .
.
【解析】试题分析:(1)根据核内质子数与核外电子数是否相等判断粒子的类型;
(2)先根据离子中核内质子数不等于核外电子数,得出离子的核内质子数,依此判断离子种类;
(3)若该粒子为原子,y=3为铝元素时的元素最高价氧化物对应水化物的化学式为Al(OH)3,y=6时为硫元素,元素最高价氧化物对应水化物的化学式为H2SO4.
解:(1)x﹣y=10时,说明x=10+y,符合核电荷数=质子数=核外电子数,是原子,
故答案为:原子;
(2)原子核电荷数=质子数=核外电子数,原子得失电子可能形成8电子稳定结构,稀有气体是8电子稳定结构;符合结构的原子为Ar,阳离子为K+、Ca2+,阴离子为S2﹣、Cl﹣等,
故答案为:K+;Cl﹣;Ar;
(3)若该粒子为原子,y=3为铝元素时的元素最高价氧化物对应水化物的化学式为Al(OH)3,y=6时为硫元素,元素最高价氧化物对应水化物的化学式为H2SO4,反应后所得溶液主要阳离子为Al3+,结构示意图为 ,故答案为:
,故答案为: .
.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目