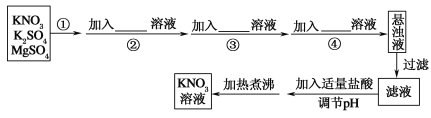
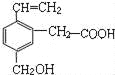
题目内容
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到的气体其物质的量为a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1(在相同条件下),则a可能为( )
A.0.80 B.0.70 C.0.60 D.0.40[
【答案】D
【解析】
试题分析:若混合物全是CuS,其物质的量n(CuS)=n(CuO)=![]() =0.15mol,CuS中S的化合价由-2价上升到+6价,故转移电子物质的量=0.15×(6+2)=1.2mol.NO和NO2的体积相等,设NO为xmol、NO2为xmol,根据得失电子守恒,得3x+x=1.2,解得x=0.3,则NO和NO2的总物质的量为0.3mol×2=0.6mol;若混合物全是Cu2S,其物质的量n(Cu2S)=
=0.15mol,CuS中S的化合价由-2价上升到+6价,故转移电子物质的量=0.15×(6+2)=1.2mol.NO和NO2的体积相等,设NO为xmol、NO2为xmol,根据得失电子守恒,得3x+x=1.2,解得x=0.3,则NO和NO2的总物质的量为0.3mol×2=0.6mol;若混合物全是Cu2S,其物质的量n(Cu2S)=![]() n(CuO)=
n(CuO)=![]() ×0.15mol=0.075mol,Cu2S中S的化合价由-2价上升到+6价,且Cu元素的化合价由+1价上升到+2价,故转移电子物质的量0.075×(8+1×2)=0.75mol,设NO为xmol、NO2为xmol,3x+x=0.75,根据电子得失守恒,计算得x=0.1875,故NO和NO2的总物质的量为0.1875mol×2=0.375mol,实际气体介于0.375mol~0.6mol之间,故选D。
×0.15mol=0.075mol,Cu2S中S的化合价由-2价上升到+6价,且Cu元素的化合价由+1价上升到+2价,故转移电子物质的量0.075×(8+1×2)=0.75mol,设NO为xmol、NO2为xmol,3x+x=0.75,根据电子得失守恒,计算得x=0.1875,故NO和NO2的总物质的量为0.1875mol×2=0.375mol,实际气体介于0.375mol~0.6mol之间,故选D。

练习册系列答案
相关题目