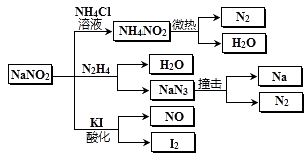
题目内容
【题目】建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
![]() NaNO2+
NaNO2+![]() HI―→
HI―→![]() NO↑+
NO↑+![]() I2+
I2+![]() NaI+
NaI+![]() H2O
H2O
(1)配平上面方程式。_________
(2)上述反应的氧化剂是________;若有 1 mol 的还原剂被氧化,则反应中转移电子的数目是________。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白酒 ⑤食醋,进行实验,下列选项合适的是________(填字母)。
A.③⑤ B.①②④
C.①②⑤ D.①②③⑤
(4)某厂废液中,含有2%~5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为_________________________。
【答案】 2 4 2 1 2 2 NaNO2 6.02×1023 C NaNO2+NH4Cl===NaCl+N2↑+2H2O
【解析】(1)在该反应中NaNO2中的N元素化合价降低1价生成NO,HI中I元素化合价升高1价生成I2,另有一部分生成NaI,所以配平后的方程式为2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;
(2) 反应中NaNO2中的N元素化合价降低,NaNO2作氧化剂,HI中I元素化合价升高,HI作还原剂,所以有1 mol HI被氧化,则转移电子的数目是为NA或6.02×1023;
(3)根据上述反应可知,在酸性条件下,NO2—可把I—氧化生成I2,而Cl—没有氧化性,不能与I—反应,又I2遇淀粉显蓝色,因此可用①②⑤进行实验来鉴别NaNO2和NaCl,所以正确选项为C;
(4)根据叙述可知,反应物为NaNO2和NH4Cl,生成物为N2,结合质量守恒可推知还有NaCl和H2O,所以反应的化学方程式为NaNO2+NH4Cl==NaCl+N2↑+2H2O。

 习题精选系列答案
习题精选系列答案【题目】请回答下列问题:
(1)纯水在T℃时,pH=6,该温度下1molL﹣1的NaOH溶液中,由水电离出的c(OH﹣)=molL﹣1 .
(2)某一元弱酸溶液(A)与二元强酸(B)的pH相等.若将两溶液稀释相同的倍数后,pH(A)pH(B) (填“>”、“=”或“<”).现用上述稀释溶液中和等浓度等体积的NaOH溶液,则需稀释溶液的体积V(A)V(B)(填“>”、“=”或“<”).
(3)已知:二元酸H2R 的电离方程式是:H2R=H++HR﹣ , HR﹣R2﹣+H+ , 若0.1molL﹣1NaHR溶液的c(H+)=a molL﹣1 , 则0.1molL﹣1H2R溶液中c(H+)(0.1+a) molL﹣1(填“<”、“>”或“=”),理由是 .
(4)电离平衡常数是衡量弱电解质电离程度的物理量.已知:
化学式 | 电离常数(25℃) |
HCN | K=4.9×10﹣10 |
CH3COOH | K=1.8×10﹣5 |
H2CO3 | K1=4.3×10﹣7、K2=5.6×10﹣11 |
①25℃时,有等浓度的HCN溶液、H2CO3溶液和CH3COOH溶液,三溶液的pH由大到小的顺序为(用化学式表示).
②向NaCN溶液中通入少量的CO2 , 发生反应的化学方程式为 .