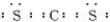题目内容
X、Y、Z、W是原子序数依次增大的前36号元素中的常见元素,其相关信息如下表:
(1)W位于元素周期表中第 周期 族,与Y同主族且与W同周期元素的基态原子核外电子排布式是 .
(2)X、Y、Z的最高价氧化物的水化物中,酸性最弱的酸是 (写化学式,下同);在WZ和XZ2两
化合物中,熔点较高的是 .
(3)氯化物ZCI2与过量氢化物YH3在无水条件下反应生成Z4Y4、单质Z和一种可以作化肥的物质,请写出相
应化学方程式 .
(4)已知:4W(s)+02(g)=2W20(s)AH=-337.2kJ.mol-l
2X(s)+02(g)=2XO(g)△H=-211.0kJ.mol-1
试计算:W20(s)+X(s)=2W(s)+XO(g)△H= kJ. mol-1.
| 元素 | 相关信息 |
| X | 同素异形体之一自然界最硬 |
| Y | 与X同周期,且最高正价与最低负价代数和为2 |
| Z | 单质用于制黑火药,燃烧时有强烈的刺激性气味 |
| W | 基态原子只有一个未成对电子,单质及其合金 在潮湿的空气中容易出现绿色锈迹 |
(2)X、Y、Z的最高价氧化物的水化物中,酸性最弱的酸是
化合物中,熔点较高的是
(3)氯化物ZCI2与过量氢化物YH3在无水条件下反应生成Z4Y4、单质Z和一种可以作化肥的物质,请写出相
应化学方程式
(4)已知:4W(s)+02(g)=2W20(s)AH=-337.2kJ.mol-l
2X(s)+02(g)=2XO(g)△H=-211.0kJ.mol-1
试计算:W20(s)+X(s)=2W(s)+XO(g)△H=
分析:X、Y、Z、W是原子序数依次增大的前36号元素中的常见元素,X元素的同素异形体之一自然界最硬,则X为C元素;Y与X同周期,且最高正价与最低负价代数和为2,则Y原子最外层电子数为5,Y为N元素;Z单质用于制黑火药,燃烧时有强烈的刺激性气味,则Z为S元素;W基态原子只有一个未成对电子,单质及其合金在潮湿的空气中容易出现绿色锈迹,则W为Cu,
(1)Cu处于第三周期第ⅠB族;与N元素同主族且与Cu同周期元素为As,根据构造原理书写核外电子排布;
(2)非金属性越弱,最高价含氧酸的酸性越弱;根据常温下物质的状态判断其熔点高低;
(3)SCl2与过量氢化物NH3在无水条件下反应生成S4N4、单质硫和NH4Cl;
(4)根据盖斯定律计算反应热.
(1)Cu处于第三周期第ⅠB族;与N元素同主族且与Cu同周期元素为As,根据构造原理书写核外电子排布;
(2)非金属性越弱,最高价含氧酸的酸性越弱;根据常温下物质的状态判断其熔点高低;
(3)SCl2与过量氢化物NH3在无水条件下反应生成S4N4、单质硫和NH4Cl;
(4)根据盖斯定律计算反应热.
解答:解:X、Y、Z、W是原子序数依次增大的前36号元素中的常见元素,X元素的同素异形体之一自然界最硬,则X为C元素;Y与X同周期,且最高正价与最低负价代数和为2,则Y原子最外层电子数为5,Y为N元素;Z单质用于制黑火药,燃烧时有强烈的刺激性气味,则Z为S元素;W基态原子只有一个未成对电子,单质及其合金在潮湿的空气中容易出现绿色锈迹,则W为Cu,
(1)Cu处于第三周期第ⅠB族;与N元素同主族且与Cu同周期元素为As,原子核外电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:三、ⅠB;1s22s22p63s23p63d104s24p3;
根据构造原理书写核外电子排布;
(2)非金属性N>C、S>C,故H2CO3的酸性最弱,常温下CuS为固体、CO2为气态,故CuS的熔点更高,
故答案为:H2CO3;CuS;
(3)SCl2与过量氢化物NH3在无水条件下反应生成S4N4、单质硫和NH4Cl,反应方程式为:6SCl2+16NH3=S4N4+2S+12NH4Cl,
故答案为:6SCl2+16NH3=S4N4+2S+12NH4Cl;
(4)已知:①、4W(s)+02(g)=2W20(s)AH=-337.2kJ.mol-l
②、2X(s)+02(g)=2XO(g)△H=-211.0kJ.mol-1
根据盖斯定律,(②-①)×
得:W20(s)+X(s)=2W(s)+XO(g),故△H=
×[(-211.0kJ.mol-1)-(-211.0kJ.mol-1)]=+63.1kJ. mol-1,
故答案为:+63.1.
(1)Cu处于第三周期第ⅠB族;与N元素同主族且与Cu同周期元素为As,原子核外电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:三、ⅠB;1s22s22p63s23p63d104s24p3;
根据构造原理书写核外电子排布;
(2)非金属性N>C、S>C,故H2CO3的酸性最弱,常温下CuS为固体、CO2为气态,故CuS的熔点更高,
故答案为:H2CO3;CuS;
(3)SCl2与过量氢化物NH3在无水条件下反应生成S4N4、单质硫和NH4Cl,反应方程式为:6SCl2+16NH3=S4N4+2S+12NH4Cl,
故答案为:6SCl2+16NH3=S4N4+2S+12NH4Cl;
(4)已知:①、4W(s)+02(g)=2W20(s)AH=-337.2kJ.mol-l
②、2X(s)+02(g)=2XO(g)△H=-211.0kJ.mol-1
根据盖斯定律,(②-①)×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:+63.1.
点评:本题考查结构性质位置关系应用、核外电子排布、反应热计算等,难度中等,注意掌握根据盖斯定律进行反应热的有关计算.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目