题目内容
【题目】欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如图所示.(已知:碳酸不能溶解Al(OH)3沉淀) 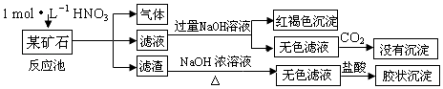
(1)用滤渣制备粗硅的化学反应方程式为
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3b.结合质子的能力:CO32﹣>AlO2﹣>HCO3﹣
c.稳定性:H2O>CH4>SiH4d.离子半径:O2﹣<Al3+
(3)滤渣和NaOH溶液反应的离子方程式是 , 通过现象说明此矿山中不含Al2O3
(4)该矿石和稀HNO3发生氧化还原反应的离子方程式为 .
【答案】
(1)2C+SiO2 ![]() Si+2CO↑
Si+2CO↑
(2)ac
(3)SiO2+2OH﹣=SiO32﹣+H2O;无色溶液中通入CO2无白色沉淀生成
(4)3FeCO3+10H++NO3﹣=3Fe3++3CO2↑+NO↑+5H2O
【解析】解:矿石中加入稀硝酸生成气体、可溶性物质,同时又溶性物质生成,生成气体说明含有FeCO3 , SiO2不溶于稀硝酸,通过实验现象说明含有SiO2 , 向滤渣中加入NaOH溶液得到无色滤液,二氧化硅和NaOH溶液反应生成偏铝酸钠,向偏铝酸钠溶液中加入稀盐酸生成硅酸胶体沉淀;滤液中加入NaOH溶液得到红褐色沉淀说明滤液中含有铁离子,向无色滤液中通入二氧化碳没有沉淀,说明无色滤液中不含偏铝酸钠,则矿石中不含Al2O3 , (1)滤渣为二氧化硅,二氧化硅和C在高温下反应生成Si,反应方程式为2C+SiO2 ![]() Si+2CO↑,
Si+2CO↑,
所以答案是:2C+SiO2 ![]() Si+2CO↑;(2)a.非金属性:C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故a正确;
Si+2CO↑;(2)a.非金属性:C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故a正确;
b.酸性:H2CO3>HCO3﹣>Al(OH)3 , 对应的酸越强,则酸根离子得到质子的能力越弱,则结合质子能力:AlO2﹣>CO32﹣>HCO3﹣ , 故b错误;
c.非金属性O>C>Si,元素的非金属性越强,对应的氢化物越稳定,故c正确;
d.两种离子核外电子排布相同,核电荷数越大,离子半径越小,则O2﹣>Al3+ , 故d错误;
所以答案是:ac;(3)二氧化硅和NaOH溶液反应生成偏铝酸钠和水,离子方程式为SiO2+2OH﹣=SiO32﹣+H2O;偏铝酸钠溶液能和过量二氧化碳反应生成氢氧化铝沉淀,该流程图中无色溶液中通入二氧化碳没有白色沉淀生成,说明不含氧化铝,
所以答案是:SiO2+2OH﹣=SiO32﹣+H2O; 无色溶液中通入CO2无白色沉淀生成;(4)该矿石和稀HNO3发生氧化还原反应为碳酸亚铁和硝酸的反应,生成铁离子、二氧化碳、NO和水,反应方程式为3FeCO3+10H++NO3﹣=3Fe3++3CO2↑+NO↑+5H2O,所以答案是:3FeCO3+10H++NO3﹣=3Fe3++3CO2↑+NO↑+5H2O.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案