题目内容
将0.1 mol/L的NH3·H2O溶液加水稀释,下列说法正确的是( )
| A.c(NH)/c(NH3·H2O)比值减小 | B.OH-个数将减少 |
| C.c(OH-)/c(NH3·H2O)比值减小 | D.NH4+浓度将减小 |
D
试题分析:在0.1 mol/L的NH3·H2O溶液中存在电离平衡:NH3·H2O
 NH4++OH-。当加水稀释时,A. 假如平衡不发生移动c(NH3·H2O)、c(NH4+)的浓度都减小,由于生成物的系数大,稀释的倍数多,所以平衡向电离的方向移动,c(NH3·H2O)比稀释的倍数大,c(NH4+)比稀释的倍数小,所以c(NH4+)/c(NH3·H2O)比值增大。错误。B.加水稀释促进了物质的大量,所以OH-个数将增大。错误。C.加水时c(OH-)、c(NH3·H2O)都减小,因为平衡正向移动,所以c(OH-)减小的倍数小于c(NH3·H2O)减小的不是,因此c(OH-)/c(NH3·H2O)比值增大。错误。D.加水稀释,尽管平衡向电离的方向移动,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,因此NH4+浓度将减小。正确。
NH4++OH-。当加水稀释时,A. 假如平衡不发生移动c(NH3·H2O)、c(NH4+)的浓度都减小,由于生成物的系数大,稀释的倍数多,所以平衡向电离的方向移动,c(NH3·H2O)比稀释的倍数大,c(NH4+)比稀释的倍数小,所以c(NH4+)/c(NH3·H2O)比值增大。错误。B.加水稀释促进了物质的大量,所以OH-个数将增大。错误。C.加水时c(OH-)、c(NH3·H2O)都减小,因为平衡正向移动,所以c(OH-)减小的倍数小于c(NH3·H2O)减小的不是,因此c(OH-)/c(NH3·H2O)比值增大。错误。D.加水稀释,尽管平衡向电离的方向移动,但是稀释作用大于平衡正向移动使离子浓度增大的趋势,因此NH4+浓度将减小。正确。
练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
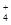 )之和
)之和 H++HO2-,HO2-
H++HO2-,HO2-