题目内容
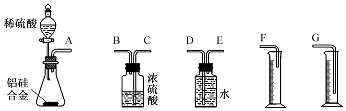
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示
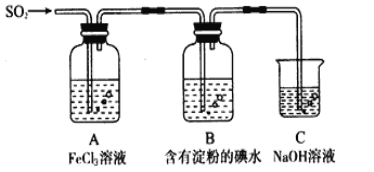
请按要求回答下列问题
(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与热浓硫酸
(2)装置C的作用是____________。如果有560mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为____________mol/L才能达到目的。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、________、洗涤、自然干燥。在这一系列操作中没有用到的仪器有(填序号)____。
A.蒸发皿 B.分液漏斗 C.漏斗 D.玻璃棒 E.冷凝管
(4)在上述装置中通入过量的SO2,请设计实验验证SO2与Fe3+发生了氧化还原反应________________。
(5)本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为______________。
【答案】 BD 除去尾气中的SO2,防止污染空气 0.5 过滤 BE 取反应后A中试液少许,加入KSCN溶液,不变红,再加入新制的氯水,溶液变红(或取反应后A中试液少许,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀,或其它合理答案) B中溶液的蓝色褪去 SO2+I2+2H2O=SO42-+2I-+4H+
【解析】(1)A.硝酸具有强氧化性,把亚硫酸钠氧化成硫酸钠,得不到二氧化硫,故A错;B.浓硫酸虽具有强氧化性性,但不能氧化亚硫酸钠,故B正确;C.固体硫在纯氧中燃烧,操作不容易控制,故C错误;D.Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故D正确;故选BD;
CuSO4+SO2↑+2H2O,故D正确;故选BD;
(2)二氧化硫是酸性氧化物具有刺激性气味,直接排放污染大气,能和碱反应生成盐和水,所以可用碱液处理二氧化硫;如果有560mL SO2气体(已折算为标态)物质的量=![]() =0.025mol,进入C装置中发生反应为SO2+NaOH=NaHSO3,则C中消耗氢氧化钠物质的量为0.025mol,50mL NaOH溶液的浓度至少为
=0.025mol,进入C装置中发生反应为SO2+NaOH=NaHSO3,则C中消耗氢氧化钠物质的量为0.025mol,50mL NaOH溶液的浓度至少为![]() =0.5mol/L;
=0.5mol/L;
(3)通过加热浓缩、冷却结晶、过滤、洗涤、自然干燥等操作即可从A中所得溶液提取晶体;蒸发使用仪器:A.蒸发皿;E.玻璃棒;过滤使用仪器:C.漏斗;D.烧杯;E.玻璃棒;故答案为:BE;
(4)取反应后A中试液少许,加入KSCN溶液,不变红,说明溶液里不含Fe3+,再加入新制的氯水,溶液变红,可知反应的A溶液中含有Fe2+,即可证明SO2与Fe3+发生了氧化还原反应;
(5)I2+SO2+2H2O=2HI+H2SO4,则二氧化硫能使含有碘的淀粉溶液褪色,即说明发生了氧化还原反应,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性,发生反应的离子方程式为SO2+I2+2H2O=SO42-+2I-+4H+。