题目内容
下图是N2与H2反应生成NH3的过程中能量变化的曲线图:下列叙述正确的是( )。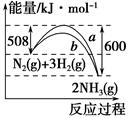
| A.该反应的热化学方程式为 N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
BD
解析

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于反应热的说法正确的是
| A.当△H<O时,表示该反应为吸热反应 |
B.已知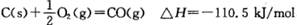 ,说明碳的燃烧热为110kJ/mol ,说明碳的燃烧热为110kJ/mol |
| C.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
| D.化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 |
已知下列热化学方程式:Zn(s) + 1/2 O2(g)= ZnO(s) △H1;Hg(l) + 1/2 O2(g)=HgO(s) △H2;
则 Zn(s)+ HgO(s)=Hg(l)+ ZnO(s),△H值为
| A.△H2-△H1 | B.△H2+△H1 | C.△H1-△H2 | D.-△H1-△H2 |
含20.0 g NaOH的稀溶液与稀盐酸完全反应时,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是
A.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" +28.7" kJ·mol-1 =" +28.7" kJ·mol-1 |
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) =" -28.7" kJ·mol-1 =" -28.7" kJ·mol-1 |
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)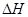 =" +57.4" kJ·mol-1 =" +57.4" kJ·mol-1 |
D.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l)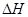 =" -57.4" kJ·mol-1 =" -57.4" kJ·mol-1 |
用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2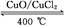 2Cl2+2H2O
2Cl2+2H2O
已知:Ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
Ⅱ.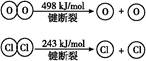
判断下列说法正确的是( )
| A.反应A的ΔH>-115.6 kJ/mol |
| B.断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为32 kJ |
| C.H2O中H—O键比HCl中H—Cl键弱 |
| D.由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
下列图示与对应的叙述相符的是( )。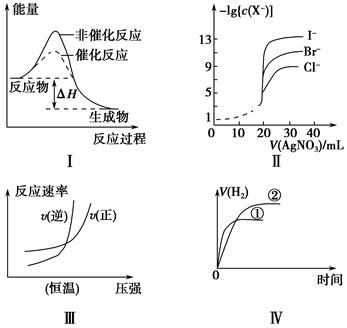
| A.图Ⅰ中ΔH表示某一反应有无催化剂的反应热相同 |
| B.用0.010 0 mol·L-1硝酸银标准溶液,滴定浓度均为0.100 0 mol·L-1 Cl-、Br-及I-的混合溶液,由图Ⅱ曲线,可确定首先沉淀的是Cl- |
| C.图Ⅲ可表示工业合成氨反应在温度一定的情况下反应速率与压强的关系 |
| D.图Ⅳ表示相同体积、相同pH的一元强酸溶液①和一元弱酸溶液②分别与足量的锌粉发生反应,V(H2)随时间的变化曲线 |
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ·mol-1、ΔH=-285.8 kJ·mol-1、ΔH=-890.3 kJmol-1、ΔH=-2 800 kJ·mol-1,则下列热化学方程式正确的是 ( )。
A.C(s)+ O2(g)===CO(g) ΔH=-393.5 kJ·mol-1 O2(g)===CO(g) ΔH=-393.5 kJ·mol-1 |
| B.2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1 |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1 |
D. C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)ΔH=-1 400 kJ·mol-1 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(g)ΔH=-1 400 kJ·mol-1 |
现有两个热化学反应方程式: (l)+H2(g)
(l)+H2(g)
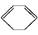 (l) ΔH>0①
(l) ΔH>0① 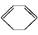 (l)+2H2(g)
(l)+2H2(g)
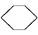 (l) ΔH<0②
(l) ΔH<0②
下列说法中不正确的是( )
| A.①②都属于加成反应 |
| B.在通常条件下,①②都能自发进行 |
| C.①吸热、②放热的事实说明苯环中含有的并不是碳碳双键 |
| D.①②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
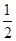 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2