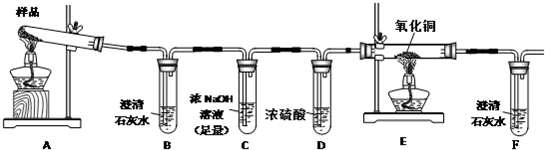
题目内容
请设计实验方案证明以下抗酸药含有氢氧化铝,并完成下列探究活动记录: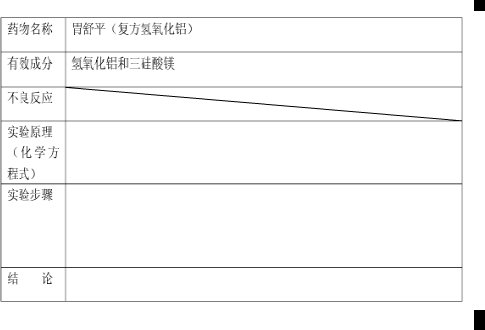
解:氢氧化铝可以和酸反应,还可以和强碱发生反应,要检验氢氧化铝的存在,可以先取药片研碎加入到试管中,加入足量的稀盐酸,含有的氢氧化铝会和盐酸反应生成氯化铝,再加入氢氧化钠会出现白色沉淀氢氧化铝,再继续加入氢氧化钠会生成澄清的溶液偏铝酸钠,据此可以知道含有氢氧化铝,
故答案为:实验原理:Al(OH)3+3HCl=AlCl3+3H2O,AlCl3+3NaOH=Al(OH)3+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O;
实验步骤:先取药片研碎加入到试管中,加入足量的稀盐酸,过滤得到澄清溶液,再向滤液中加入氢氧化钠,看是否会出现白色沉淀,若果生成,继续加入氢氧化钠,看沉淀是否溶解;
结论:胃舒平中含有氢氧化铝.
分析:氢氧化铝可以和酸反应,还可以和强碱发生反应,所以可以据此来解答该题.
点评:本题主要考查学生氢氧化铝的性质:既能和强酸反应又能和强碱反应,难度不大.
故答案为:实验原理:Al(OH)3+3HCl=AlCl3+3H2O,AlCl3+3NaOH=Al(OH)3+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O;
实验步骤:先取药片研碎加入到试管中,加入足量的稀盐酸,过滤得到澄清溶液,再向滤液中加入氢氧化钠,看是否会出现白色沉淀,若果生成,继续加入氢氧化钠,看沉淀是否溶解;
结论:胃舒平中含有氢氧化铝.
分析:氢氧化铝可以和酸反应,还可以和强碱发生反应,所以可以据此来解答该题.
点评:本题主要考查学生氢氧化铝的性质:既能和强酸反应又能和强碱反应,难度不大.

练习册系列答案
相关题目
苯酚具有弱酸性,在空气中易被氧化.工业上以苯、硫酸、氢氧化钠、亚硫酸钠为原料合成苯酚的方法可简单表示为:
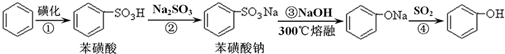
(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为 (填序号).
A.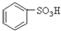 B.
B.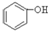 C.H2SO3
C.H2SO3
(2)步骤④与使用CO2相比,使用SO2的优点是 (答一个方面).
(3)经反应④得到的产物除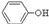 外、可能还含有OH-、S
外、可能还含有OH-、S
、HS
等微粒.请设计实验方案,证明溶液中存在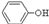 、S
、S
、HS
,写出实验步骤、预期现象和结论.
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol?L-1盐酸、1mol?L-1 BaCl2溶液、品红溶液、0.01mol?L-1酸性KMnO4溶液、1mol?L-1FeCl3溶液、饱和溴水等.
(4)纯度测定:称取1.00g产品溶解于足量温水中,向其中加入足量饱和溴水(产品中除苯酚外,不含其它与饱和溴水反应生成沉淀的物质),苯酚全部生成三溴苯酚沉淀,经过滤、洗涤、干燥后,称得沉淀质量为3.31g,则产品中苯酚的质量分数为 .

(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为
A.
 B.
B. C.H2SO3
C.H2SO3(2)步骤④与使用CO2相比,使用SO2的优点是
(3)经反应④得到的产物除
 外、可能还含有OH-、S
外、可能还含有OH-、S| O | 2- 3 |
| O | - 3 |
 、S
、S| O | 2- 3 |
| O | - 3 |
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol?L-1盐酸、1mol?L-1 BaCl2溶液、品红溶液、0.01mol?L-1酸性KMnO4溶液、1mol?L-1FeCl3溶液、饱和溴水等.
| 实验步骤 | 预期现象和结论 | ||
| 步骤1:取少量待测液于试管中,加入足量的1mol?L-1BaCl2溶液,静置、过滤,得滤液和沉淀.将滤液分置于试管A、B中,沉淀置于试管C中. | |||
| 步骤2:往试管A中加入 |
| ||
| 步骤3:往试管B中加入 |
|||
| 步骤4:往试管C中加入2mol?L-1盐酸酸化,再滴入1~2滴品红溶液. |
|

 HSO3-+OH-
HSO3-+OH-