题目内容
【题目】下表是元素周期表的一部分,请按要求回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | … | |||||||
2 | … | ② | ③ | ④ | |||||
3 | ⑤ | … | ⑥ | ⑦ | ⑧ | ⑨ | |||
4 | … | ⑩ |
(1)④、⑤、⑥的原子半径由大到小的顺序是________(用元素符号表示)
(2)②、⑦两种元素最高价氧化物对应的水化物中酸性最强的是 ______(用化学名称表示),能证明以上结论的化学方程式是 ______________________________________
(3)第三周期元素形成的简单离子中半径最小的微粒是_____(用离子符号表示),写出⑥元素的单质与⑤最高价氧化物对应的水化物反应的离子方程式____________________。
(4)元素③、⑧的氢化物中,沸点较低的物质的结构式是_____; 请简述理由_______________。
(5)①、③、④、⑥元素可形成含10个电子的微粒,其中A和B为分子,C和E为阳离子,D为阴离子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。用电子式表示下列4种微粒。
A________、B________、C________、D________。
(6)⑨元素与⑩元素两者核电荷数之差是 ____________ 。
【答案】 Na>Al>O 碳酸 Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,或者Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3 Al3+ 2Al+2OH-+2H2O =2AlO2-+3 H2↑ 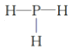 NH3分子间存在分子间氢键,PH3分子间不存在分子间氢键,存在分子间氢键的沸点高于不含有分子间氢键的沸点
NH3分子间存在分子间氢键,PH3分子间不存在分子间氢键,存在分子间氢键的沸点高于不含有分子间氢键的沸点 ![]()
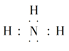
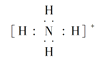 [:
[:![]() :H]- 18
:H]- 18
【解析】考查元素周期表和元素周期律的应用,以及化学用语的书写,(1)根据元素周期表,推断出④为O,⑤为Na,⑥为Al,因此原子半径大小顺序是Na>Al>O;(2)②为C,其最高价氧化物对应的水化物为H2CO3,⑦为Si,其最高价氧化物对应的水化物为H2SiO3,非金属性越强,其最高价氧化物对应水化物的酸性越强,同主族从上到下,非金属性增强,即C的非金属性强于Si,H2CO3的酸性强于H2SiO3,利用酸性强的制取酸性弱的,反应方程式为Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,或者Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3;(3)第三周期元素形成简单离子中半径最小的元素是Al3+,⑥为Al,⑤为Na,其最高价氧化物对应的水化物是NaOH,离子反应方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;(4)③为N,⑧为P,氢化物分别为NH3、PH3,因为NH3分子间存在分子间氢键,PH3分子间不存在分子间氢键,存在分子间氢键的沸点高于不含有分子间氢键的沸点,因此PH3沸点低,PH3的结构式为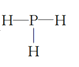 ;(5)①为H,③为N,④为O,⑥Al,构成10电子微粒,其中A和B为分子,应是H2O和NH3,B溶于A后所得物质可电离,因此B为NH3,A为H2O,即有NH3+H2O
;(5)①为H,③为N,④为O,⑥Al,构成10电子微粒,其中A和B为分子,应是H2O和NH3,B溶于A后所得物质可电离,因此B为NH3,A为H2O,即有NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,C为阳离子,即C为NH4+,D为阴离子,即D为OH-,H2O、NH3、E三种微粒反应后可得NH4+和一种白色沉淀,此离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,A、B、C、D电子式分别是
NH4++OH-,C为阳离子,即C为NH4+,D为阴离子,即D为OH-,H2O、NH3、E三种微粒反应后可得NH4+和一种白色沉淀,此离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,A、B、C、D电子式分别是 ![]() 、
、 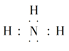 、
、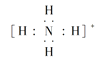 、[:
、[:![]() :H]- ;(6)⑨为Cl,⑩为Br,两者位于VIIA族,同主族相邻两种元素相差的原子序数为Br所在周期所含的元素序数,即18。
:H]- ;(6)⑨为Cl,⑩为Br,两者位于VIIA族,同主族相邻两种元素相差的原子序数为Br所在周期所含的元素序数,即18。

 名校课堂系列答案
名校课堂系列答案