题目内容
(7分)某元素的一种同位素 ,其氯化物化学式为XCl2,取该氯化物1.11g
,其氯化物化学式为XCl2,取该氯化物1.11g
溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内质子数与中子数相同,则:
(1)通过计算求得A值(约等于相对原子质量)为 ;
(2)X元素在周期表中的位置 ;
(3)根据已学知识推测,把X的单质放入水中反应的化学方程式为.
 ,其氯化物化学式为XCl2,取该氯化物1.11g
,其氯化物化学式为XCl2,取该氯化物1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内质子数与中子数相同,则:
(1)通过计算求得A值(约等于相对原子质量)为 ;
(2)X元素在周期表中的位置 ;
(3)根据已学知识推测,把X的单质放入水中反应的化学方程式为.
(1) 40(3分) (2)第四周期、ⅡA族(2分) (3) Ca+2H2O="===" Ca(OH)2+H2↑(2分)
氯化物和硝酸银反应生成氯化银沉淀,所以根据硝酸银的物质的量可以计算出氯离子的物质的量,即氯离子是0.020L×1mol/L=0.020mol。所以氯化物的物质的量是0.010mol。则其相对分子质量是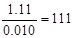 ,因此X的质量数是111-35.5×2=40。又因为这种同位素原子核内质子数与中子数相同,所以质子数是20,即是钙元素。钙的金属性其余钠的,和水剧烈反应生成氢氧化钙和氢气。
,因此X的质量数是111-35.5×2=40。又因为这种同位素原子核内质子数与中子数相同,所以质子数是20,即是钙元素。钙的金属性其余钠的,和水剧烈反应生成氢氧化钙和氢气。
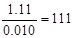 ,因此X的质量数是111-35.5×2=40。又因为这种同位素原子核内质子数与中子数相同,所以质子数是20,即是钙元素。钙的金属性其余钠的,和水剧烈反应生成氢氧化钙和氢气。
,因此X的质量数是111-35.5×2=40。又因为这种同位素原子核内质子数与中子数相同,所以质子数是20,即是钙元素。钙的金属性其余钠的,和水剧烈反应生成氢氧化钙和氢气。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目