题目内容
某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应.
(1)在甲酸进行银镜反应前,必须在其中加入一定量的 ,因为 ;
(2)写出甲酸进行银镜反应的化学方程式:
(3)某同学很成功的做了银镜反应,他肯定没有进行的操作________(写字母):
E、用小火对试管直接加热;
F、反应过程中,振荡试管使之充分反应.
然后,同学们对甲酸与甲醇进行了酯化反应的研究:
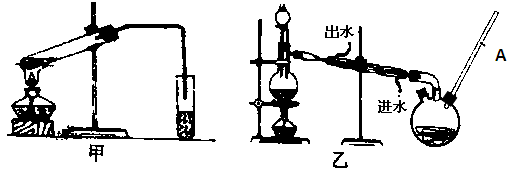
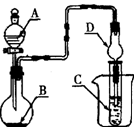
(4)乙装置中长导管A的作用是 ;
(5)写出甲酸和甲醇进行酯化反应的化学方程式
(6)选择甲装置还是乙装置好?________,原因是 ;
(7)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有________、________两种必备用品.
(8)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,
请给予合理的解释 。
(1)在甲酸进行银镜反应前,必须在其中加入一定量的 ,因为 ;
(2)写出甲酸进行银镜反应的化学方程式:
(3)某同学很成功的做了银镜反应,他肯定没有进行的操作________(写字母):
| A.用洁净的试管; |
| B.在浓度为2%的NH3·H2O中滴入稍过量的浓度为2%的硝酸银; |
| C.用前几天配制好的银氨溶液; |
| D.在银氨溶液里加入稍过量的甲酸; |
F、反应过程中,振荡试管使之充分反应.
然后,同学们对甲酸与甲醇进行了酯化反应的研究:
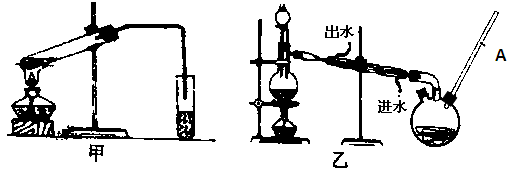
(4)乙装置中长导管A的作用是 ;
(5)写出甲酸和甲醇进行酯化反应的化学方程式
(6)选择甲装置还是乙装置好?________,原因是 ;
(7)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有________、________两种必备用品.
(8)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,
请给予合理的解释 。
.(1)NaOH(Na2CO3)溶液 反应必须在碱性条件下发生
(2)HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag+2NH3+H2O(其他合理的答案也给分)
(NH4)2CO3+2Ag+2NH3+H2O(其他合理的答案也给分)
(3)BCDEF (4)冷凝回流
(5)HCOOH+CH3OH HCOOCH3+H2O
HCOOCH3+H2O
(6)乙, 冷凝效果好,减少了甲醇等有毒物质对大气的污染.
(7)饱和碳酸钠溶液、碎瓷片(沸石) (8) 强碱性条件下,甲酸甲酯水解了
(2)HCOOH+2Ag(NH3)2OH
 (NH4)2CO3+2Ag+2NH3+H2O(其他合理的答案也给分)
(NH4)2CO3+2Ag+2NH3+H2O(其他合理的答案也给分)(3)BCDEF (4)冷凝回流
(5)HCOOH+CH3OH
 HCOOCH3+H2O
HCOOCH3+H2O(6)乙, 冷凝效果好,减少了甲醇等有毒物质对大气的污染.
(7)饱和碳酸钠溶液、碎瓷片(沸石) (8) 强碱性条件下,甲酸甲酯水解了
(1)甲酸含有醛基,但显酸性。所以在进行银镜反应之前,需要先加入氢氧化钠或碳酸钠溶液中和酸使其呈解析。
(2)甲酸发生银镜反应的方程式为HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag+2NH3+H2O
(NH4)2CO3+2Ag+2NH3+H2O
(3)银氨溶液需要随用随配,且在配制时应该将氨水滴入硝酸银溶液中,银镜反应需要在碱性环境中进行,且需要水浴加热。同时在反应过程中不能震荡试管,所以错误的是BCDEF。
(4)为了防止甲酸甲酯的挥发,长导管A起冷凝回流作用。
(5)反应的方程式为HCOOH+CH3OH HCOOCH3+H2O。
HCOOCH3+H2O。
(6)乙装置的冷凝效果好,减少了甲醇等有毒物质对大气的污染
(7)酯化反应需要加热,所以为了防止暴沸,应该加入碎瓷片。同时为了分离得到甲酸甲酯,还需要饱和碳酸钠溶液。
(8)甲酸甲酯在碱性条件下几乎是完全水解的,所以得不到甲酸甲酯。
(2)甲酸发生银镜反应的方程式为HCOOH+2Ag(NH3)2OH
 (NH4)2CO3+2Ag+2NH3+H2O
(NH4)2CO3+2Ag+2NH3+H2O(3)银氨溶液需要随用随配,且在配制时应该将氨水滴入硝酸银溶液中,银镜反应需要在碱性环境中进行,且需要水浴加热。同时在反应过程中不能震荡试管,所以错误的是BCDEF。
(4)为了防止甲酸甲酯的挥发,长导管A起冷凝回流作用。
(5)反应的方程式为HCOOH+CH3OH
 HCOOCH3+H2O。
HCOOCH3+H2O。(6)乙装置的冷凝效果好,减少了甲醇等有毒物质对大气的污染
(7)酯化反应需要加热,所以为了防止暴沸,应该加入碎瓷片。同时为了分离得到甲酸甲酯,还需要饱和碳酸钠溶液。
(8)甲酸甲酯在碱性条件下几乎是完全水解的,所以得不到甲酸甲酯。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目







 变红,又集得能使带火星的木条复燃的气体0.28L(标况下)。
变红,又集得能使带火星的木条复燃的气体0.28L(标况下)。