题目内容
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
如图1所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了16 g。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示。请回答下列问题:
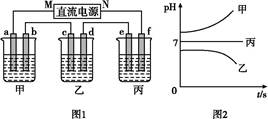
(1) M为直流电源的 极,b电极上发生的电极反应为 。
(2)计算e电极上生成的气体在标准状况下的体积为 。
(3)写出乙烧杯中的总反应的离子方程式: 。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量) 。
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | S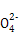 、OH- 、OH- |

(1) M为直流电源的 极,b电极上发生的电极反应为 。
(2)计算e电极上生成的气体在标准状况下的体积为 。
(3)写出乙烧杯中的总反应的离子方程式: 。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量) 。
(1)负 4OH--4e-=2H2O+O2↑
(2)5.6 L (3) 2Cu2++2H2O 2Cu+4H++O2↑
2Cu+4H++O2↑
(4)向丙烧杯中加4.5 g水
(2)5.6 L (3) 2Cu2++2H2O
 2Cu+4H++O2↑
2Cu+4H++O2↑(4)向丙烧杯中加4.5 g水
乙中c电极质量增加了16 g,说明c电极上有铜析出,所以c电极是阴极,则M是负极。常温下各烧杯中溶液的pH与电解时间t的关系如图2所示,甲溶液pH增大,所以甲中盛放的只能是碱,乙中pH降低且有铜生成,说明该溶液是硫酸铜溶液,丙中溶液的pH不变,说明电解的是水且溶液的浓度增大对其pH无影响,所以是强酸强碱盐。(1)M是负极,则b是阳极,阳极上氢氧根离子失电子生成水和氧气,所以电极反应式为4OH--4e-=2H2O+O2↑。(2)e是阴极,e上氢离子得电子生成氢气,根据转移电子数相同
 ~
~ ~
~ ,生成16 g铜转移电子0.5 mol,所以生成氢气的体积标准状况下是5.6 L。 (3)电解硫酸铜溶液时析出铜和氧气,同时生成硫酸,电池反应式为 2Cu2++2H2O
,生成16 g铜转移电子0.5 mol,所以生成氢气的体积标准状况下是5.6 L。 (3)电解硫酸铜溶液时析出铜和氧气,同时生成硫酸,电池反应式为 2Cu2++2H2O 2Cu+4H++O2↑。(4)丙烧杯中电解的是水,根据转移电子守恒或关系式2H2O=2H2↑+O2↑~4e-~2Cu知,电解4.5 g水,所以向丙烧杯中加4.5 g水即可。
2Cu+4H++O2↑。(4)丙烧杯中电解的是水,根据转移电子守恒或关系式2H2O=2H2↑+O2↑~4e-~2Cu知,电解4.5 g水,所以向丙烧杯中加4.5 g水即可。
 ~
~ ~
~ ,生成16 g铜转移电子0.5 mol,所以生成氢气的体积标准状况下是5.6 L。 (3)电解硫酸铜溶液时析出铜和氧气,同时生成硫酸,电池反应式为 2Cu2++2H2O
,生成16 g铜转移电子0.5 mol,所以生成氢气的体积标准状况下是5.6 L。 (3)电解硫酸铜溶液时析出铜和氧气,同时生成硫酸,电池反应式为 2Cu2++2H2O 2Cu+4H++O2↑。(4)丙烧杯中电解的是水,根据转移电子守恒或关系式2H2O=2H2↑+O2↑~4e-~2Cu知,电解4.5 g水,所以向丙烧杯中加4.5 g水即可。
2Cu+4H++O2↑。(4)丙烧杯中电解的是水,根据转移电子守恒或关系式2H2O=2H2↑+O2↑~4e-~2Cu知,电解4.5 g水,所以向丙烧杯中加4.5 g水即可。
练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
 4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融 氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是
4Na+2H2O+O2↑。后来盖·吕萨克用铁与熔融 氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH=Fe3O4+4Na↑+2H2↑。下列有关说法不正确的是

 H2↑阳极:4OH--4e-
H2↑阳极:4OH--4e-