题目内容
下列相关离子方程式书写正确的是 ( )。
| A.NaClO溶液与FeCl2溶液混合:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+3Cl-+4Fe3+ |
| B.用食醋检验牙膏中的碳酸钙:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2=2Fe3++2H2O |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
A
解析

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
在加入铝粉能放出H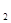 的溶液中,下列各组离子一定不能大量共存的是( )
的溶液中,下列各组离子一定不能大量共存的是( )
A.Na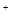 、Fe 、Fe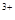 、SO 、SO 、Cl 、Cl |
B.Ba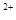 、Mg 、Mg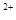 、HCO 、HCO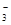 、NO 、NO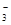 |
C.Na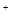 、K 、K 、NO 、NO 、CO 、CO |
D.K 、NO 、NO 、AlO 、AlO 、OH 、OH |
下表中对离子方程式的评价不合理的是
| 选项 | 化学反应及离子方程式 | 评价 |
| A | NaClO溶液中通入少量的SO2:ClO-+H2O+SO2===Cl-+SO42-+2H+ | 错误,碱性介质中不可能生成H+ |
| B | 用酸性高锰酸钾溶液滴定草酸:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O | 正确 |
| C | NH4Al(SO4)2溶液中滴入几滴NaOH溶液:NH4++OH-===NH3·H2O | 错误,OH-首先和Al3+反应生成Al(OH)3沉淀 |
| D | 用惰性电极电解MgCl2溶液:2Mg2++2H2O 2Mg+O2↑+4H+ 2Mg+O2↑+4H+ | 正确 |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1mol/L KMnO4溶液:K+、Na+、I-、Cl- |
| B.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3- |
| C.加入KSCN显红色的溶液:K+、Mg2+、Cl-、SO42- |
| D.水电离出c(OH-)=10-5mol/L的溶液:Na+、Fe2+、Cl-、NO3- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- |
| B.10 mol·L-1的浓氨水:Al3+、NH4+、NO3-、I— |
| C.0.1 mol·L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl— |
| D.c(H+)/c(OH—)=1×10—12的溶液:K+、Na+、AlO2—、CO32— |
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能溶解Al2O3的溶液:Na+、K+、 、 、 |
| B.0.1 mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl- |
C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、 |
D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、 |
下列离子方程式表示正确的是( )。
| A.往FeI2溶液中通入过量氯气:Cl2+2Fe2+=2Cl-+2Fe3+ |
| B.将明矾溶于水中生成胶体:Al3++3H2O??Al(OH)3(胶体)+3H+ |
| C.大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
某废水中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、AlO2一、CO32-、S2一、SO32-、SO42-
现取该溶液进行有关实验,实验过程及现象如下: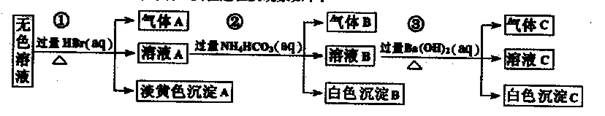
下列说法正确的是
| A.根据实验①中的现象可推出,气体A一定是纯净物,淡黄色沉淀一定是AgBr |
| B.根据实验②中的现象可推出,气体B是CO2,沉淀B是Al(OH)3,原溶液中一定含有Al3+ |
| C.根据实验③中的现象可推出,气体C是NH3,沉淀C一定有BaCO3,可能有BaSO4 |
| D.原溶液中肯定含有Na+、AlO2-、S2-,不能确定是否含有SO32-、SO42- |
下列现象描述、化学方程式或离子方程式和反应类型都正确的是( )
| 选项 | 操作方法 | 主要现象 | 化学方程式或离子方程式 | 反应 类型 |
| A | 氢气在氯气中燃烧 | 蓝色 火焰 | H2+Cl2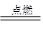 2HCl 2HCl | 化合 反应 |
| B | SO2通入硝酸 钡溶液中 | 产生白色沉淀 | Ba(NO3)2+SO2+H2O= BaSO3↓+2HNO3 | 复分解反应 |
| C | 常温下,足量 的Cl2通入 FeBr2溶液中 | 浅绿色变黄色 | 2Fe2++Cl2=2Fe3++2Cl- | 氧化还原反应 |
| D | 硫化氢通 入碘水中 | 颜色变浅产生 淡黄色固体 | H2S+I2=S↓+2HI | 氧化还原反应 |