题目内容
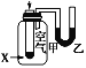
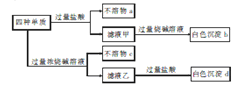
【题目】如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子。电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为:2CH3OH+3O2==2CO2+4H2O。下列说法不正确的是
A. 左边的电极为电池的负极,a处通入的是甲醇
B. 每消耗3.2 g氧气转移的电子为0.4 mol
C. 电池负极的反应式为:CH3OH + H2O 6e===CO2+ 6H+
D. 电池的正极反应式为:O2+2H2O+4e===4OH
【答案】D
【解析】根据质子、电子移动方向,可知a是负极,a处通入的是甲醇,故A正确;根据总反应,每消耗3.2 g氧气转移的电子为0.4 mol,故B正确;电池负极的反应式为:CH3OH + H2O 6e=CO2+ 6H+,故C正确;电池的正极反应式为:O2+4H++4e=2H2O,故D错误。

 阅读快车系列答案
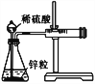
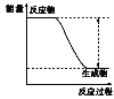
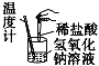
阅读快车系列答案【题目】下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是:
A | B | C | D | |
反应 装置或 图像 |
|
|
|
|
实验现 象或图 像信息 | 反应开始 后,针筒活 塞向右移动 | 反应物总能 量大于生成 物总能量 | 反应开始后, 甲处液面低 于乙处液面 | 温度计的 水银柱不 断上升 |
A. A B. B C. C D. D
【题目】防治雾雾霾天气的主要措施有机动车临时交通管制、工矿企业停业限产、扬尘污染控制等。
(l) PM2.5是环保部门监测空气质量的重要指标。将某PM2.5样本用蒸馏水处理制成待测试样,测得试样中无机离子的种类和平均浓度如下表:
离子种类 | Na+ | NH4+ | SO42- | NO3- |
浓度/(mol/L) | 2.0×l0-6 | 2.8×10-5 | 3.5×10-5 | 6.0×l0-5 |
则试样的pH为____________。
(2)雾霾的主要成分之一是来自汽车尾气的氮氧化物,研究表明CH4可以消除汽车尾气中氮氧化物的污染。
① CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-889.6KJ/mol
② N2(g)+2O2(g)=2NO2(g)ΔH=+67.2KJ/mol
③ 2NO2(g) ![]() N2O4(g) ΔH=-56.9KJ/mol
N2O4(g) ΔH=-56.9KJ/mol
写出甲烷气体催化还原N2O4气体生成稳定的单质气体、二氧化碳气体和液态水的热化学方程式:_____。
(3)一定条件下,以CO 和H2合成清洁能源CH3OH,其热化学方程式为CO(g) + 2H2(g) ![]() CH3OH (g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:
CH3OH (g) ΔH,CO的平衡转化率与温度、压强的关系如图所示:
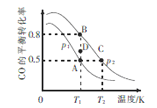
①该可逆反应的ΔH_____0(填“>”“<”“=”)。A,B, C三点对应的平衡常数KA、KB、KC的大小关系是_________。压强:p1_______p2(填“>”“<”“=”)。在T1条件下,由D点到B点过程中,正、逆反应速率之间的关系:v正________v逆(填“>”“<”“=”)。
②若在恒温恒容条件下进行上述反应,能表示该可逆反应达到平衡状态的是__________(填字母)
A. CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内消耗CO的浓度等于生成CH3OH的浓度
③向恒压密闭容器中充入2mol CO和4mol H2,在p2、T2条件下达到平衡状态C点,此时容器容积为2L,则在该条件下反应的平街常数K为______________。
【题目】下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ⑧ | |||||
(1)①~⑦元素中金属性最强的元素是___________(用元素符号表示)。
(2)④与⑤形成的化合物的电子式为____________。
(3)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。
(4)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为“![]() ”,该元素在元素周期表中的位置是_____________,属于______元素(填“金属”或“非金属”),若该元素存在最高价氧化物对应的水化物,则其化学式为_______。
”,该元素在元素周期表中的位置是_____________,属于______元素(填“金属”或“非金属”),若该元素存在最高价氧化物对应的水化物,则其化学式为_______。
(5)核内中子数为N的R2+,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为________mol。