题目内容
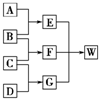
 根据如图的转化关系完成下列有关问题:
根据如图的转化关系完成下列有关问题:(1)写出①的离子方程式:
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
| ||
MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O
.写出②的离子方程式:
| ||
Br2+2I-═2Br-+I2
Br2+2I-═2Br-+I2
.(2)推出下列物质或溶液中溶质的化学式:E
KCl
KCl
;IAgBr
AgBr
.(3)在上述转化过程中,B、C、F、H氧化能力由弱到强的顺序是(写化学式)
I2<Br2<Cl2<MnO2
I2<Br2<Cl2<MnO2
.分析:H使淀粉溶液呈蓝色说明 H为I2;因F(橙色)+G(钾盐)→I2+D,所以F为溴水,D为KBr,I为AgBr;又因为C+KBr→Br2+E,说明C的氧化性比Br2强,则C可能为Cl2,E为KCl;B为黑色粉末为MnO2,A为浓盐酸,符合转化关系,据此解答.
解答:解:H使淀粉溶液呈蓝色说明 H为I2;因F(橙色)+G(钾盐)→I2+D,所以F为溴水,D为KBr,I为AgBr;又因为C+KBr→Br2+E,说明C的氧化性比Br2强,则C可能为Cl2,E为KCl;B为黑色粉末为MnO2,A为浓盐酸,符合转化关系,
(1)①的离子方程式为:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O;②的离子方程式为:Br2+2I-═2Br-+I2;
故答案为:MnO2+2Cl-+4H+
Mn2++Cl2↑+2H2O;Br2+2I-═2Br-+I2;
(2)由上述分析可知,E为KCl,I为AgBr,
故答案为:KCl;AgBr;
(3)氧化剂的氧化性强于氧化产物的氧化性,在上述转化过程中,B、C、F、H氧化能力由弱到强的顺序是:,
故答案为:I2<Br2<Cl2<MnO2.
(1)①的离子方程式为:MnO2+2Cl-+4H+
| ||
故答案为:MnO2+2Cl-+4H+
| ||
(2)由上述分析可知,E为KCl,I为AgBr,
故答案为:KCl;AgBr;
(3)氧化剂的氧化性强于氧化产物的氧化性,在上述转化过程中,B、C、F、H氧化能力由弱到强的顺序是:,
故答案为:I2<Br2<Cl2<MnO2.
点评:本题以框图形式考查无机物的推断,H使淀粉溶液呈蓝色是推断的突破口,利用猜测验证法推断A与B,难度中等,注意掌握元素化合物的性质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



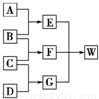
 A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).
A、B、C和D均为短周期元素组成的非金属单质.其中B、C、D在常温下为气态,A为固体,W为含42个电子的离子化合物.它们满足如图的转化关系(反应条件略).