题目内容
【题目】设NA为阿伏加德罗常数,下列有关说法正确的是( )
A.1mol甲基(-CH3)所含的电子总数为8NA
B.0.5mol苯分子中含有C=C双键数为1.5NA
C.11.2L甲醛所含分子数为0.5NA
D.14g乙烯、丙烯的混合气体所含原子数为3NA
【答案】D
【解析】
A.1mol甲基(-CH3)所含的电子为7mol,即总数为7NA,A错误;
B.苯分子中无碳碳双键,是一种介于碳碳单键和碳碳双键之间的特殊结构,B错误;
C.题目未指明环境,若不是标准状况下,无法进行判断,C错误;
D.乙烯为CH2=CH2,丙烯为CH3CH=CH2,最简式CH2相等,即可视为气体CH2 14g,所含原子数为3NA,D正确。
答案为D。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】CoCl2· 6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、 Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2· 6H2O的工艺流程如下:
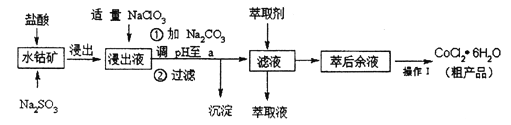
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表(金属离子浓度为0.01 mol/L):
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co (OH) 2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2· 6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中主要发生的离子反应方程式:______________。
(2)若不慎向“浸出液”中加过量NaC1O3时,可能会生成的有害气体是_______(填化学式)。
(3)萃取剂对金属离子的萃取率与pH的关系如图,向“滤液”中加入萃取剂的目的是_______,其使用的最佳pH范围是 ________(选填下列字母)。

A. 2.0~2.5 B. 3.0~3.5 C. 4.0~4.5 D. 5.0~5.5
(4) “操作1”是________。制得的CoCl2· 6H2O需减压烘干的原因是__________。
(5)为测定粗产品中CoCl2· 6H2O的含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2· 6H2O的质量分数大于100%,其原因可能是___________________。(答一条即可)

