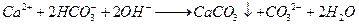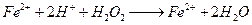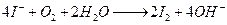题目内容
下列离子方程式书写正确的是 ( )
| A.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO- = CaSO3↓+2HClO |
B.NH4HSO3溶液与足量的NaOH溶液混合后加热:NH4+ +HSO3- +2OH-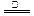 NH3↑+SO32-+2H2O NH3↑+SO32-+2H2O |
| C.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3- +5I-+3H2O=3I2+6OH- |
| D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42- = CaSO4↓+H2O |
B。
Ca(ClO)2具有强氧化性,应把SO2氧化成SO42-,产物中不可能有CaSO3生成, A错;B项中,NaOH过量,不是以NH3·H2O的形式存在,而以NH3气体的形式放出,正确。选项C中在酸性条件下,不可能有OH-生成,正确的离子方程式应为IO3- +5I-+6H+ = 3I2+3H2O;D项中,因微溶的Ca(OH)2就是溶液,所以生成的微溶的CaSO4会因溶液体积增大而更难沉淀,其正确的离子方程式应为OH-+H+ = 2H2O,D项错。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
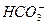 +OH-====CaCO3↓+H2O
+OH-====CaCO3↓+H2O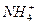 +
+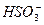
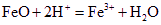
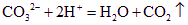 CO
CO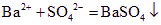
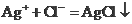
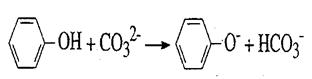
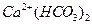 溶液和NaOH溶液混合
溶液和NaOH溶液混合