题目内容
反应N2O4(g) 2NO2(g) ΔH= +57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法错误的是
2NO2(g) ΔH= +57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法错误的是
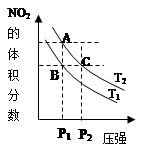
A.A、B、C三点中气体 颜色最深的为C点
B.维持压强不变,由B点到A点反应向正方向进行
C.A、C两点的反应速率:A>C
D.B、C两点化学平衡常数:B<C
 2NO2(g) ΔH= +57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法错误的是
2NO2(g) ΔH= +57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法错误的是 
A.A、B、C三点中气体 颜色最深的为C点
B.维持压强不变,由B点到A点反应向正方向进行
C.A、C两点的反应速率:A>C
D.B、C两点化学平衡常数:B<C
C
试题分析:N2O4(g)
 2NO2(g) ΔH= +57kJ·mol-1,从这可以看出,该反应为吸热反应,所以温度升高,平衡向正反应方向移动,故颜色加深;减小压强,平衡向正反应方向移动,颜色加深,从图中可以看出,T1<T2,P1< P2,图中C点可以通过A点加压而得到,B点很明显的颜色小于C点,故A、B、C三点中气体 颜色最深的为C点,故A正确,维持压强不变,由B点到A点保持压强不变,升高温度的过程,所以反应向正方向进行,故B正确,C点可以通过A点加压而得到,所以A、C两点的反应速率为A<C,故C错误,为本题的答案;B、C两点化学平衡常数:B<C,因为温度高,平衡常数大。
2NO2(g) ΔH= +57kJ·mol-1,从这可以看出,该反应为吸热反应,所以温度升高,平衡向正反应方向移动,故颜色加深;减小压强,平衡向正反应方向移动,颜色加深,从图中可以看出,T1<T2,P1< P2,图中C点可以通过A点加压而得到,B点很明显的颜色小于C点,故A、B、C三点中气体 颜色最深的为C点,故A正确,维持压强不变,由B点到A点保持压强不变,升高温度的过程,所以反应向正方向进行,故B正确,C点可以通过A点加压而得到,所以A、C两点的反应速率为A<C,故C错误,为本题的答案;B、C两点化学平衡常数:B<C,因为温度高,平衡常数大。点评:本题考查了化学平衡的综合知识,该考点是高考考查的重点和难点,本题难度比较大,考生很容易错选A选项。

练习册系列答案
相关题目
 W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是
W(g) + Z(g),下列物理量不能用于表明反应是否已达到平衡状态的是 H2S(g) K1,
H2S(g) K1, SO2(g) K2。则相同温度下反应H2(g)+SO2(g)
SO2(g) K2。则相同温度下反应H2(g)+SO2(g) 
 CH3OH(g)反应合成甲醇。
CH3OH(g)反应合成甲醇。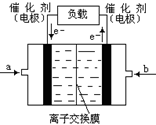
 B+C,在某一温度时,达到平衡。
B+C,在某一温度时,达到平衡。  2NH3(g),若N2、H2、NH3的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( )
2NH3(g),若N2、H2、NH3的起始浓度分别为C1、C2、C3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是( ) 2NH3而言,无论怎样控制反应条件1mol N2与3mol H2反应都不会生成2mol NH3
2NH3而言,无论怎样控制反应条件1mol N2与3mol H2反应都不会生成2mol NH3