题目内容
现有几种弱电解质的电离度(25℃,0.1mol?L-1)如下表:
|
分析:A、弱电解质溶液中电离度越大,溶液中氢离子浓度越大,酸性越强;①CH3COOH②HF③HCN,三种一元酸的电离度分别为:1.3;7.8;0.0079;酸性由强到弱的顺序是②>①>③;
B、相同物质的量浓度的①CH3COONa ②NaF③NaCN,①CH3COOH②HF③HCN酸性由强到弱的顺序是②>①>③,越弱越水解,溶液碱性越强;
C、NaF溶液中存在水解平衡,加盐酸促进氟离子的水解,氢离子浓度增大,氟离子浓度减小,钠离子浓度减小;
D、氟离子水解显碱性,溶液中离子浓度大小为:[Na+]>[F-]>[OH-]>[H+].
B、相同物质的量浓度的①CH3COONa ②NaF③NaCN,①CH3COOH②HF③HCN酸性由强到弱的顺序是②>①>③,越弱越水解,溶液碱性越强;
C、NaF溶液中存在水解平衡,加盐酸促进氟离子的水解,氢离子浓度增大,氟离子浓度减小,钠离子浓度减小;
D、氟离子水解显碱性,溶液中离子浓度大小为:[Na+]>[F-]>[OH-]>[H+].
解答:解:A、弱电解质溶液中电离度越大,溶液中氢离子浓度越大,酸性越强;①CH3COOH②HF③HCN,三种一元酸的电离度分别为:1.3、7.8、0.0079;酸性由强到弱的顺序是②>①>③,故A错误;
B、相同物质的量浓度的①CH3COONa ②NaF③NaCN,①CH3COOH②HF③HCN酸性由强到弱的顺序是②>①>③,越弱越水解,溶液碱性越强,所以溶液PH大小为:③>①>②,故B错误;
C、NaF溶液中存在水解平衡,加盐酸促进氟离子的水解,氢离子浓度增大,氟离子浓度减小,钠离子浓度减小,故C错误;
D、氟离子水解显碱性,溶液中离子浓度大小为:[Na+]>[F-]>[OH-]>[H+],故D正确;
故选D.
B、相同物质的量浓度的①CH3COONa ②NaF③NaCN,①CH3COOH②HF③HCN酸性由强到弱的顺序是②>①>③,越弱越水解,溶液碱性越强,所以溶液PH大小为:③>①>②,故B错误;
C、NaF溶液中存在水解平衡,加盐酸促进氟离子的水解,氢离子浓度增大,氟离子浓度减小,钠离子浓度减小,故C错误;
D、氟离子水解显碱性,溶液中离子浓度大小为:[Na+]>[F-]>[OH-]>[H+],故D正确;
故选D.
点评:本题考查了盐类水解的应用,弱电解质的电离平衡分析,弱电解质电离度的分析应用,溶液中离子浓度大小比较,题目难度中等.

练习册系列答案
相关题目
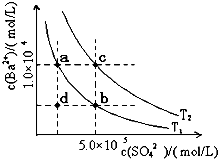
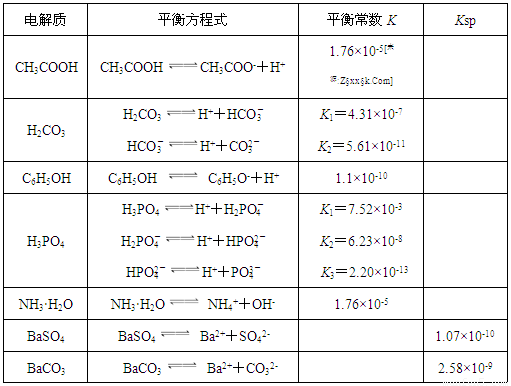
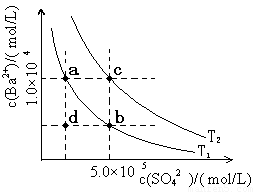
 BaCO3(s)+ SO42- (aq) ]
BaCO3(s)+ SO42- (aq) ]