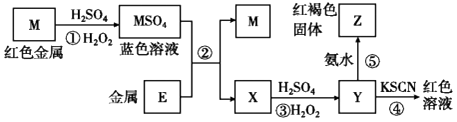
题目内容
【题目】常温下S2Cl2是橙黄色液体,其分子结构如图所示.少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液.下列关于S2Cl2的说法错误的是( ) 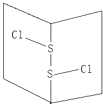
A.为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔沸点S2Br2>S2Cl2
D.与水反应的化学方程式可能为2S2Cl2+2H2O→SO2↑+3S↓+4HCl
【答案】A
【解析】解:A、该分子中,电荷的分布是不均匀的,不对称的,所以是极性分子,故A错误.B、Cl﹣S﹣S﹣Cl 中硫原子和硫原子之间存在非极性键,硫原子和氯原子之间存在极性键,故B正确.
C、S2Br2与S2Cl2均属于分子晶体,分子晶体中,分子量越大则熔沸点越高,所以熔沸点:S2Br2>S2Cl2 , 故C正确.
D、Cl﹣S﹣S﹣Cl 遇水易水解,并产生酸性悬浊液,说明有不溶于水的物质生成,且有溶于水呈酸性的物质生成,根据反应前后元素守恒知,生成不溶于水的物质是S单质,同时生成二氧化硫和氯化氢,所以水解方程式为2S2Cl2+2H2O→SO2↑+3S↓+4HCl,故D正确.
故选:A.
A、分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,是不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
B、同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键.
C、分子晶体中,分子量越大则熔沸点越高;
D、遇水易水解,并产生酸性悬浊液,说明有沉淀生成、有酸性物质生成.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目