题目内容
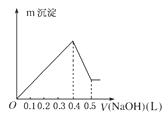
【题目】现有MgSO4和AlCl3混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为( )
A. 1:6
B. 1:3
C. 6:1
D. 3:1
【答案】C
【解析】
根据图中关系可以知道,加入氢氧化钠溶液0.4L时,发生反应AlCl3![]() (OH)3↓、MgSO4
(OH)3↓、MgSO4![]() Mg(OH)2↓,则0.4
Mg(OH)2↓,则0.4![]() 0.5L时NaOH发生与氢氧化铝的反应,由铝原子守恒可判断原溶液中的铝离子,即得出氯离子的量,根据加入0
0.5L时NaOH发生与氢氧化铝的反应,由铝原子守恒可判断原溶液中的铝离子,即得出氯离子的量,根据加入0![]() 0.4L氢氧化钠溶液时发生反应AlCl3
0.4L氢氧化钠溶液时发生反应AlCl3![]() (OH)3↓、MgSO4
(OH)3↓、MgSO4![]() Mg(OH)2↓,求出Mg2+的量,进而得到SO42-的物质的量,据此解答。
Mg(OH)2↓,求出Mg2+的量,进而得到SO42-的物质的量,据此解答。
第一条上升的直线是表示AlCl3和MgSO4一起产生沉淀,第二条下降的直线表示![]() (OH)3沉淀溶解,设氢氧化钠溶液的浓度为c,根据
(OH)3沉淀溶解,设氢氧化钠溶液的浓度为c,根据![]() (OH)3+OH-=AlO2-+2H2O,第二条直线可以知道加入0.1L的NaOH将氢氧化铝完全溶解,可以知道AlCl3是0.1cmol,则氯离子的物质的量为0.3cmol,再根据Al3++3OH-=
(OH)3+OH-=AlO2-+2H2O,第二条直线可以知道加入0.1L的NaOH将氢氧化铝完全溶解,可以知道AlCl3是0.1cmol,则氯离子的物质的量为0.3cmol,再根据Al3++3OH-=![]() (OH)3↓,由这些氯化铝完全沉淀消耗氢氧化钠溶液0.3L;
(OH)3↓,由这些氯化铝完全沉淀消耗氢氧化钠溶液0.3L;
再根据第一条直线可以知道,0.4L-0.3L=0.1L的氢氧化钠将镁离子全部沉淀,而Mg2++2OH-= Mg(OH)2↓,所以MgSO4为0.05cmol,所以硫酸根离子的物质的量为0.05cmol,
所以原溶液中Cl-与SO42-的物质的量之比为0.3cmol :0.05cmol =6:1,
所以C选项是正确的。

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目