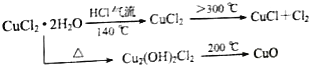��Ŀ����
����Ŀ���о���ҵ������Ĵ����ͷ��ξ�����Ҫ�����壮
��1�����÷�ӦCH4+2NO2 ![]() N2+CO2+2H2O������NO2����Ⱦ���÷�Ӧ���������� �� ������CH4�������11.2L����״���£�ʱ�������Ͽɴ���molNO2 ��
N2+CO2+2H2O������NO2����Ⱦ���÷�Ӧ���������� �� ������CH4�������11.2L����״���£�ʱ�������Ͽɴ���molNO2 ��
��2����������β����CO��NO��һ�ַ����ǣ��������������а�װһ����ת��װ�ã���װ���ܽ�CO��NOת��Ϊ�������ѭ���������壮�÷�Ӧ�Ļ�ѧ����ʽΪ
��3��ij�����ŷŵĹ�ҵ��ˮ�п��ܺ���Fe3+��Al3+��Cu2+ �� Ϊ�˼��ٻ�����Ⱦ�����Ϊ�������÷���м�Ƶ�Fe2O3��Al2O3�ͽ���Cu���������£�
�ٹ���A�ijɷ��� �� ���ѧʽ��
����ҺB�е��������� ��
��D�����H��Һ��Ӧ����E�����ӷ���ʽ�� ��
����ҺE��ɫ�ʻ�ɫ���Լ�H�� ��
���𰸡�
��1��NO2��1
��2��2NO+2CO ![]() N2+2CO2
N2+2CO2
��3��Fe��Cu��Fe3+��Al3+��Fe2+��Al3++4OH���TAlO ![]() +2H2O��NaOH��Һ
+2H2O��NaOH��Һ
���������⣺��1�����������е���+4�۱��0�ۣ����Զ������������������ݷ�ӦCH4+2NO2 ![]() N2+CO2+2H2O��֪1mol�ļ�������2mol�Ķ������������Ե�����CH4�������11.2L����״���£�ʱ�������Ͽɴ���1molNO2 �� ���Դ��ǣ�NO2��1����2���ڴ���������NO��CO��Ӧ������CO2��N2 �� ��Ӧ�ķ���ʽΪ��2NO+2CO
N2+CO2+2H2O��֪1mol�ļ�������2mol�Ķ������������Ե�����CH4�������11.2L����״���£�ʱ�������Ͽɴ���1molNO2 �� ���Դ��ǣ�NO2��1����2���ڴ���������NO��CO��Ӧ������CO2��N2 �� ��Ӧ�ķ���ʽΪ��2NO+2CO ![]() N2+2CO2 �� ���Դ��ǣ�2NO+2CO
N2+2CO2 �� ���Դ��ǣ�2NO+2CO ![]() N2+2CO2����3�������̿�֪��ij�����ŷŵĹ�ҵ��ˮ�к�Fe3+��Al3+��Cu2+ �� �ȼӹ�����2Fe3++Fe�T3Fe2+ �� ���ڽ����˳���������ͭ��ǰ�棬�������۰�ͭ�û�����������Fe+Cu2+�TCu+2Fe2+ �� ��������������֪����A�к�Fe��Cu���Լ�GΪ���ᣬCu�������Ӧ�������CΪCu����ҺB�к�Fe3+��Al3+��Fe2+ �� ����ˮ��+2�۵������ӱ���ˮ������2Fe2++Cl2=2Fe3++2Cl�����ټӹ���D���ɳ���F����ҺE����DΪǿ����Һ����ҺEΪƫ�����Σ�����FΪFe��OH��3 �� ��������������֪��AΪFe��Cu�����Դ��ǣ�Fe��Cu������ҺB�еĽ����������У�Fe3+��Al3+��Fe2+ �� ���Դ��ǣ�Fe3+��Al3+��Fe2+����D�����H��Һ��Ӧ����E�����ӷ���ʽ�ǣ�Al3++4 OH���TAlO2��+2H2O�����Դ��ǣ�Al3++4 OH���TAlO2��+2H2O����EΪƫ�����Σ�����ҺE��ɫ�ʻ�ɫ����EΪƫ�����ƣ���HΪNaOH��Һ�����Դ��ǣ�NaOH��Һ��
N2+2CO2����3�������̿�֪��ij�����ŷŵĹ�ҵ��ˮ�к�Fe3+��Al3+��Cu2+ �� �ȼӹ�����2Fe3++Fe�T3Fe2+ �� ���ڽ����˳���������ͭ��ǰ�棬�������۰�ͭ�û�����������Fe+Cu2+�TCu+2Fe2+ �� ��������������֪����A�к�Fe��Cu���Լ�GΪ���ᣬCu�������Ӧ�������CΪCu����ҺB�к�Fe3+��Al3+��Fe2+ �� ����ˮ��+2�۵������ӱ���ˮ������2Fe2++Cl2=2Fe3++2Cl�����ټӹ���D���ɳ���F����ҺE����DΪǿ����Һ����ҺEΪƫ�����Σ�����FΪFe��OH��3 �� ��������������֪��AΪFe��Cu�����Դ��ǣ�Fe��Cu������ҺB�еĽ����������У�Fe3+��Al3+��Fe2+ �� ���Դ��ǣ�Fe3+��Al3+��Fe2+����D�����H��Һ��Ӧ����E�����ӷ���ʽ�ǣ�Al3++4 OH���TAlO2��+2H2O�����Դ��ǣ�Al3++4 OH���TAlO2��+2H2O����EΪƫ�����Σ�����ҺE��ɫ�ʻ�ɫ����EΪƫ�����ƣ���HΪNaOH��Һ�����Դ��ǣ�NaOH��Һ��