题目内容
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是 (用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 (填字母)。
A.c(H+)
B.![]()
C.c(H+)·c(OH-)
D.![]()
E.![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式 。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)= (填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为_________。
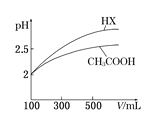
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如右图所示,则HX的电离平衡常数___________(填“>”、”=”或“<”)CH3COOH的电离平衡常数。
(7)标准状况下,将1.12 L CO2通入100 mL 1 mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c(OH-)=2c(H2CO3)+_____________________。
②c(H+)+c(Na+)=________________________。
【答案】(1)a<d<c<b (2)B、D
(3)ClO-+CO2+H2O=HCO3-+HClO
(4)9.9×10-7 mol·L-1(或10-6-10-8)
(5) 107×b/(ab) (6) >
(7)①c(HCO3-)+c(H+) ②c(OH-)+c(HCO3-)+2c(CO32-)
【解析】
试题分析:(1)四种溶液中,只有CH3COOH是酸,显示酸性,水解程度:CO32﹣>ClO﹣>HCO3﹣,水解均显碱性,水解程度越大,碱性越强,所以碱性顺序是:Na2CO3>NaClO>NaHCO3,即pH由小到大的排列顺序是CH3COOH<NaHCO3<NaClO<Na2CO3,故答案为:adcb;
(2)A、0.1molL﹣1的CH3COOH溶液加稀释过程中,电离程度增大,氢离子浓度减小,A错误;B、0.1molL﹣1的CH3COOH溶液加稀释过程中,微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,所以c(H+)/c(CH3COOH)增大,B正确;C、Kw=c(H+)c(OH﹣)只受温度的影响,温度不变则其值是一个常数,C错误;D、醋酸稀释,酸性减弱,c(H+)减小,碱性增强,c(OH﹣)增大,即c(OH﹣)/c(H+)增大,D正确;E、该比值表示电离平衡常数,温度不变,平衡常数不变,E错误,答案选BD。
(3)向次氯酸钠溶液中通入少量二氧化碳的离子方程式为ClO-+CO2+H2O=HCO3-+HClO。
(4)CH3COOH与CH3COONa的混合溶液中,存在电荷守恒:c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),所以c(CH3COO﹣)﹣c(Na+)=c(H+)﹣c(OH﹣)=10﹣6mol/L﹣10﹣8mol/L=9.9×10﹣7mol/L。
(5)将a molL-1的醋酸溶液与b molL-1的氢氧化钠溶液等体积混合,溶液呈中性,说明醋酸过量,醋酸和氢氧化钠溶液发生反应CH3COOH+NaOH=CH3COONa+H2O,则溶液中c(CH3COOH)=(ab)/2molL-1,达到电离平衡时,溶液呈中性,氢离子浓度是1×10-7molL-1,c(Na+)=c(CH3COO-)=b/2molL-1,则k=c(CH3COO)×c(H+)/c(CH3COOH) =107×b/(ab);
(6)根据CH3COOH与一元酸HX加水稀释过程中pH与溶液体积的关系图可以看出HX酸在稀释过程中溶液的pH变化比醋酸的大,所以酸性HX强于醋酸,电离程度:HX>CH3COOH;
(7)①标准状况下,将1.12L CO2是0.05mol,和 0.1mol的NaOH反应后生成碳酸钠,溶液呈碱性,根据质子守恒可知c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+);
②根据电荷守恒可知c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)。

 阅读快车系列答案
阅读快车系列答案

