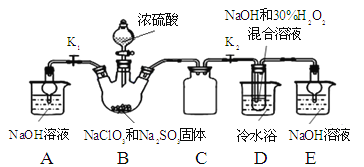
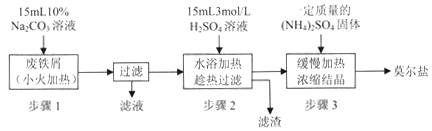
题目内容
【题目】【天津市红桥区2017届高三上学期期末考试】一定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5 mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
【答案】D
【解析】
A、H2S是二元弱酸,H2S ![]() H++HS-,HS-
H++HS-,HS-![]() H++S2-,c(H+)> c(HS-),故错误;B、NH3·H2O是弱碱,部分电离,稀释10倍,促进电离,pH应是a-1<b<a,故错误;C、按照电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故错误;D、依据越弱越水解,酸性:CH3COOH>H2CO3>HClO,因此水解程度:ClO->HCO3->CH3COO-,因此相同pH时,c(CH3COONa)>c(NaHCO3)>c(NaClO),因此c(Na+):①>②>③,故正确。离子浓度大小是高考的高频题,几乎每年都会涉及,此类题题目,往往从以下几个角度考虑:(1)电离理论,①弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离,如氨水溶液中c(NH3·H2O)>c(OH-)>c(NH4+),②多元弱酸的电离是分步进行的,其主要是第一级电离;(2)水解理论,①弱离子的水解损失是微量(双水解除外),但由于水的电离,因此水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质溶液的浓度,如NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O),②多元弱酸根离子的水解是分步的,其主要是第一步水解;(3)电荷守恒→注重溶液呈中性,特别注意前面的系数;(4)物料守恒→注重溶液中某元素的原子守恒;(5)质子守恒→注重分子或离子得失H+数目不变;对酸式根离子是电离还是水解,结合题目信息进行处理;解决此类问题要头脑冷静,结合掌握知识细心推断,见到等号,立即想到三个守恒的思想。
H++S2-,c(H+)> c(HS-),故错误;B、NH3·H2O是弱碱,部分电离,稀释10倍,促进电离,pH应是a-1<b<a,故错误;C、按照电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-),故错误;D、依据越弱越水解,酸性:CH3COOH>H2CO3>HClO,因此水解程度:ClO->HCO3->CH3COO-,因此相同pH时,c(CH3COONa)>c(NaHCO3)>c(NaClO),因此c(Na+):①>②>③,故正确。离子浓度大小是高考的高频题,几乎每年都会涉及,此类题题目,往往从以下几个角度考虑:(1)电离理论,①弱电解质的电离是微弱的,电离产生的微粒都非常少,同时还要考虑水的电离,如氨水溶液中c(NH3·H2O)>c(OH-)>c(NH4+),②多元弱酸的电离是分步进行的,其主要是第一级电离;(2)水解理论,①弱离子的水解损失是微量(双水解除外),但由于水的电离,因此水解后酸性溶液中c(H+)或碱性溶液中c(OH-)总是大于水解产生的弱电解质溶液的浓度,如NH4Cl溶液:c(Cl-)>c(NH4+)>c(H+)>c(NH3·H2O),②多元弱酸根离子的水解是分步的,其主要是第一步水解;(3)电荷守恒→注重溶液呈中性,特别注意前面的系数;(4)物料守恒→注重溶液中某元素的原子守恒;(5)质子守恒→注重分子或离子得失H+数目不变;对酸式根离子是电离还是水解,结合题目信息进行处理;解决此类问题要头脑冷静,结合掌握知识细心推断,见到等号,立即想到三个守恒的思想。

【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | R |
利用表中元素回答下列问题:
(1)X元素在周期表中的位置为__________。
(2)气态氢化物水溶液呈碱性的元素是_____________,此氢化物的电子式__________。
(3)下列事实能说明Y元素的非金属性比硫元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1mol硫得电子多
c.Y和硫两元素的简单氢化物受热分解,前者的分解温度高
(4)![]() 和
和![]() 是元素R的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为w g,则
是元素R的两种稳定的天然同位素,它们的原子质量分别为a g和b g,在自然界中所占的原子百分比分别为m%和n%,已知12C原子的质量为w g,则![]() 的相对原子质量的表达式为___________,元素R的相对原子质量的表达式为______________________。
的相对原子质量的表达式为___________,元素R的相对原子质量的表达式为______________________。
(5)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体中相对分子质量较大的气体的分子式及物质的量为__________、_____________,生成硫酸铜的物质的量为__________。