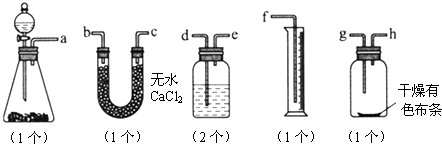
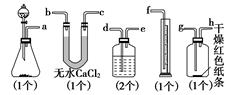
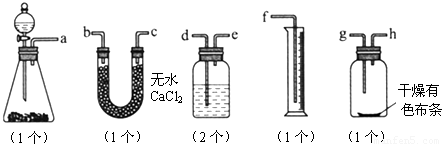
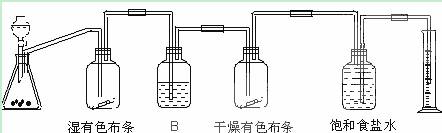
题目内容
(12分)已知漂白粉与浓盐酸反应产生氯气:Ca(ClO)2 + 4HCl == CaCl2 + 2Cl2 + 2H2O。某同学拟用下列装置完成下列实验:①粗略测定某漂白粉中有效成分Ca(ClO)2的含量,②探究干燥纯净的氯气无漂白性,潮湿的氯气有漂白性,且漂白是其中HClO的作用。
回答下列问题:
(1)写出工业上制取漂白粉的化学方程式_________________________________
(2)标出下列反应电子转移的方向和数目,并指出反应中的氧化剂和还原剂:
Ca(ClO)2 + 4HCl == CaCl2 + 2Cl2 + 2H2O
氧化剂_______________还原剂_________________
(3)上述实验装置B中应放的试剂是_____________,作用是_____________
(4)细心的李同学思考后发现该实验对探究实验结论②,有一处明显的不足,该不足之处是(你认为没有不足,该空不填写)____________________________。
(5)某同学在某次实验时称取漂白粉样品mg,实验结束后读取量筒中水的体积为VmL,假设实验的条件是标准状况,计算该漂白粉中有效成分的含量____________________________(用含字母的百分数表示)
答案


练习册系列答案
相关题目