题目内容
20.下列反应属于离子反应和氧化还原反应,同时溶液颜色又发生变化的是( )| A. | BaCl2溶液与K2SO4溶液反应 | B. | Cl2通入NaOH溶液中 | ||
| C. | NaOH溶液与CuSO4溶液反应 | D. | Cl2通入NaI溶液中 |
分析 有离子参加的反应属于离子反应,有电子转移的化学反应是氧化还原反应,其特征是有元素化合价升降,溶液有颜色变化,则有有色物质生成或有色物质消失,据此分析解答.
解答 解:A.离子反应方程式为SO42-+Ba2+=BaSO4↓,该反应中没有元素化合价变化,所以不属于氧化还原反应,故A错误;
B.Cl2通入NaOH溶液中,该反应中Cl元素化合价变化,所以属于氧化还原反应,有离子参加属于离子反应,但是溶液的颜色没有变化,故B错误;
C.NaOH溶液与CuSO4溶液反应,有离子参加属于离子反应,该反应中没有元素化合价变化,所以不属于氧化还原反应,故C错误;
D.Cl2通入NaI溶液中,反应中Cl、I元素化合价变化,所以属于氧化还原反应,有离子参加属于离子反应,溶液由无色变为棕黄色,故D正确;
故选D.
点评 本题考查了离子反应和氧化还原反应的判断,根据是否有离子参加判断是否属于离子反应,再结合是否有电子转移分析解答,题目难度不大.

练习册系列答案
相关题目
11.${\;}_{27}^{69}$Co是放射性元素,它的核内中子数为( )
| A. | 60 | B. | 27 | C. | 33 | D. | 42 |
8.(1)下表示元素周期表的一部分
①写出元素符号:fSi;hCl;
②c、d、e、b的原子半径由大到小的顺序是Na>Mg>Al>F;
③g、h的最高价氧化物的水化物中酸性强的是HClO4;
④a、f的氢化物中稳定性强的是SiH4.
⑤a元素和氢元素形成的化合物的电子式是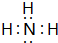 .
.
⑥c元素和b元素形成的化合物中含有的化学键类型是离子键.
(2)下表是元素周期表的一个片段,各元素均属于短周期元素
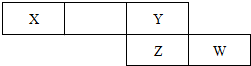
①若X的单质为空气的主要成分之一,则W的原子结构示意图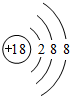 ;
;
②若Y能与钠形成反应生成淡黄色固体,则该淡黄色固体的化学式为Na2O2;含有的化学键类型有离子键、共价键.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | i |
②c、d、e、b的原子半径由大到小的顺序是Na>Mg>Al>F;
③g、h的最高价氧化物的水化物中酸性强的是HClO4;
④a、f的氢化物中稳定性强的是SiH4.
⑤a元素和氢元素形成的化合物的电子式是
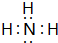 .
.⑥c元素和b元素形成的化合物中含有的化学键类型是离子键.
(2)下表是元素周期表的一个片段,各元素均属于短周期元素

①若X的单质为空气的主要成分之一,则W的原子结构示意图
 ;
;②若Y能与钠形成反应生成淡黄色固体,则该淡黄色固体的化学式为Na2O2;含有的化学键类型有离子键、共价键.
15.下列各组混合物中,不论两种物质以何种比例混合,只要总物质的量一定,完全燃烧后,消耗O2的质量不变的是( )
| A. | 乙炔和苯 | B. | 甲醛与乙醛 | C. | 甲烷和乙酸 | D. | 丙烯和丁烯 |
5.相同的甲、乙两容器中,一个充满C2H4,另一个充满C2H2和C2H6.在同温同压下,两个容器内的气体一定具有相同的( )
| A. | 原子总数 | B. | 分子总数 | C. | 质量 | D. | 密度 |
12.乙酸具有的官能团是( )
| A. | 碳碳双键 | B. | 羟基 | C. | 醛基 | D. | 羧基 |
9.正丁烷的一氯代物有几种( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
10.在①钾盐 ②铵盐 ③硝酸盐 ④硫酸盐 ⑤盐酸盐 ⑥碳酸盐中,均能溶于水的一组盐是( )
| A. | ①②⑤ | B. | ②③④ | C. | ①②③ | D. | ①③⑥ |