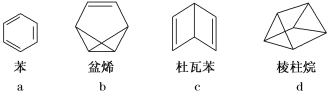
ЬтФПФкШн
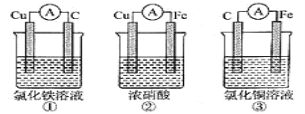
ЁОЬтФПЁПШчЭМЫљЪОЪЧZnКЭCuаЮГЩЕФдЕчГиЃЌФГЪЕбщаЫШЄаЁзщзіЭъЪЕбщКѓЃЌдкЖСЪщПЈЩЯЕФМЧТМШчЯТЃЌдђПЈЦЌЩЯЕФУшЪіКЯРэЕФЪЧЃЈ ЃЉ
ЪЕбщКѓЕФМЧТМЃК
ЂйCuЮЊИКМЋЃЌZnЮЊе§МЋ ЂкCuМЋЩЯгаЦјХнВњЩњЃЌЗЂЩњЛЙдЗДгІ ЂлSO42-ЯђCuМЋвЦЖЏ ЂмШєга0.5 molЕчзгСїОЕМЯпЃЌдђПЩВњЩњ0.25molЦјЬх ЂнЕчзгЕФСїЯђЪЧCuЁњZn Ђое§МЋЗДгІЪНЃКCu-2e-=Cu2+ЃЌЗЂЩњбѕЛЏЗДгІ
A.ЂйЂкЂлB.ЂкЂмC.ЂкЂлЂмD.ЂмЂнЂо
ЁОД№АИЁПB
ЁОНтЮіЁП
Zn-CuдЕчГижаЃЌЕчГиЗДгІZn+2H+=Zn2++H2ЁќЃЌZnзїИКМЋЗЂЩњбѕЛЏЗДгІЃЌЭЪЧе§МЋЗЂЩњЛЙдЗДгІЃЌЕчзггЩИКМЋСїЯђе§МЋЃЌвѕРызгЯђИКМЋвЦЖЏЃЌОнДЫЗжЮіХаЖЯЁЃ
ЂйZnЮЊИКМЋЃЌCuЮЊе§МЋЃЌЙЪЂйДэЮѓЃЛ
ЂкCuЕчМЋЩЯЗЂЩњ2H++2e-=H2ЁќЃЌЫљвдCuМЋЩЯгаЦјХнВњЩњЃЌЗЂЩњЛЙдЗДгІЃЌЙЪЂке§ШЗЃЛ
ЂлSO42-ЯђИКМЋаПМЋвЦЖЏЃЌЙЪЂлДэЮѓЃЛ
ЂмгЩ2H++2e-=H2ЁќПЩжЊЃЌга0.5molЕчзгСїОЕМЯпЃЌВњЩњЧтЦј0.25molЃЌЙЪЂме§ШЗЃЛ
ЂнЕчзггЩZnЕчМЋСїЯђCuЕчМЋЃЌЙЪЂнДэЮѓЃЛ
Ђое§МЋЗДгІЮЊ2H++2e-=H2ЁќЃЌЙЪЂоДэЮѓЃЛ
е§ШЗЕФгаЂкЂмЃЌЙЪбЁBЁЃ

 УЯНЈЦНаЁбЇЙіЖЏВтЪдЯЕСаД№АИ
УЯНЈЦНаЁбЇЙіЖЏВтЪдЯЕСаД№АИЁОЬтФПЁПжаЙњДЋЭГЮФЛЏжаАќРЈаэЖрПЦММжЊЪЖЁЃЯТСаЙХгяжаВЛЩцМАЛЏбЇБфЛЏЕФЪЧ
ЧЇЬдЭђфѕЫфаСПрЃЌДЕОЁПёЩГЪМЕНН№ |
АОЕЈЗЏ(CuSO4ЁЄ5H2O) ЬњИЊЃЌОУжЎврЛЏЮЊЭ |
ЗВЪЏЛв(CaCO3)ЃЌ ОЛ№ЗйСЖЮЊгУ |
ЕЄЩА(HgS)ЩежЎГЩЫЎвјЃЌЛ§БфгжГЩЕЄЩА |
A | B | C | D |
A. A B. B C. C D. D
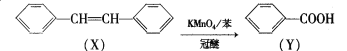
ЁОЬтФПЁПШчЭМЫљЪОЃЌФГЛЏбЇаЫШЄаЁзщЩшМЦСЫвЛИіШМСЯЕчГиЃЌВЂЬНОПТШМюЙЄвЕдРэКЭДжЭОЋСЖдРэЃЌЦфжаввзАжУжаXЮЊбєРызгНЛЛЛФЄЁЃИљОнвЊЧѓЛиД№ЯрЙиЮЪЬт:
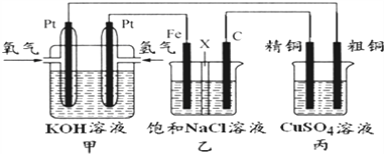
(1)ЭЈШыбѕЦјЕФЕчМЋЮЊ_____(ЬюЁАе§МЋЁБЛђЁАИКМЋЁБ)ЃЌЭЈЧтЦјвЛМЋЕФЕчМЋЗДгІЪНЮЊ_________________ЃЛ
(2)ЬњЕчМЋЮЊ_______(ЬюЁАбєМЋЁБЛђЁАвѕМЋЁБ)ЃЌввзАжУжаЕчНтЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________________ЁЃ
(3)ШєдкБъзМзДПіЯТЃЌга1.12 LбѕЦјВЮМгЗДгІЃЌБћзАжУжавѕМЋдіжиЕФжЪСПЮЊ______gЃЛ
(4)ФГДжЭжаКЌгаЬњЁЂН№ЁЂвјКЭВЌЕШдгжЪЃЌЭЈЙ§ЕчНтОЋжЦКѓЃЌЮЊДгЕчНтвКжажЦЕУСђЫсЭОЇЬх(CuSO4ЁЄ5H2O),ЩшМЦСЫШчЯТЙЄвеСїГЬ:
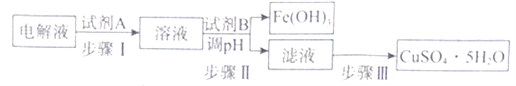
вбжЊ:МИжжН№ЪєбєРызгПЊЪМГСЕэКЭГСЕэЭъШЋЕФpH:
ЧтбѕЛЏЮяПЊЪМГСЕэЪБЕФpH | ЧтбѕЛЏЮяГСЕэЭъШЋЪБЕФpH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
ЂйВНжшIжаМгШыЪдМСAЕФФПЕФЪЧ_____________________________ЃЌЪдМСAгІбЁдё______(ЬюађКХ);
a.ТШЦј b.Й§бѕЛЏЧт C.ЫсадИпУЬЫсМиШмвК
бЁдёИУЪдМСЕФдвђ_____________________________________________________ЃЛ
ЂкВНжшIIжаЪдМСBЮЊ_________ЃЌЕїНкpHЕФЗЖЮЇЪЧ___________ЃЛ
ЂлВНжшIIIЕФВйзїЪЧМгШШХЈЫѕЁЂ_______ЁЂ___________ЁЃ