题目内容
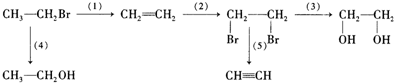
8.在同温同压下,使4体积的H2和O2混合气体充分反应,生成液态水,最后剩余1体积气体,则混合体中的H2和O2的体积比可能是( )| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
分析 氢气和氧气反应的化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,最后剩余1体积气体,则反应消耗了3体积气体,根据反应方程式计算出反应消耗的氧气和氢气的体积,再结合剩余的气体可能为氢气或氧气计算出原混合气体中氢气和氧气的体积之比.
解答 解:氢气和氧气的反应方程式为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,反应消耗的气体总体积为:4体积-1体积=3体积,
参加反应的氢气体积为:3体积×$\frac{2}{3}$=2体积,参加反应的氧气体积为:3体积-2体积=1体积,
当剩余气体为氢气时,原混合气体中氢气总体积为3体积,混合气体中的H2和O2的体积比为:3体积:1体积=3:1,
当剩余气体为氧气时,原混合气体中氧气总体积为2体积,则混合气体中的H2和O2的体积比为:2体积:2体积=1:1,
故选A.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意掌握讨论法在化学计算中的应用方法,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.(1)下表是A、B二种有机物的有关信息:
根据表中信息回答下列问题:
①A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式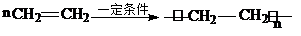 .
.
②A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
③B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大
e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2+H2O.
(2)二恶英是严重的污染物,很难降解,毒性极大,它常由焚烧垃圾产生,其中一种异构体为 ,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
| A | B |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为: 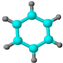 |
①A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式
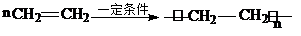 .
.②A与氢气发生加成反应后生成分子C,与C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
③B具有的性质是bc(填序号)
a.无色无味液体 b.有毒 c.不溶于水 d.密度比水大
e.能使酸性KMnO4溶液和溴水褪色 f.任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:C6H6+HNO3$→_{△}^{浓硫酸}$C6H5NO2+H2O.
(2)二恶英是严重的污染物,很难降解,毒性极大,它常由焚烧垃圾产生,其中一种异构体为
 ,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
,它的分子式为C12H4Cl4,它是属于芳香族化合物(填“是”或“否”)
16.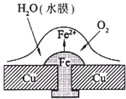 已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
 已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )
已知铅蓄电池的总反应PbO2+Pb+2H2SO4 $?_{充电}^{放电}$ 2PbSO4+2H2O,图为铁铆钉铆在铜板上,有关叙述不正确的是( )| A. | 铅蓄电池放电时,电路中每转移2mol电子,生成1mol硫酸铅 | |
| B. | 如图,铁铆钉发生吸氧腐蚀,在铁钉附近滴加K3[Fe(CN)6]溶液,可观察铁钉附近有蓝色沉淀产生 | |
| C. | 铅蓄电池充电时,阳极电极反应为 PbSO4+2H2O-2e-═PbO2+4H++SO42- | |
| D. | 铅蓄电池放电时,内电路硫酸根离子向铅极移动,正极附近溶液的pH增大 |
3.下列说法正确的是( )
| A. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| B. | 向蔗糖水解后所得溶液中加入新制Cu(OH)2煮沸会析出砖红色沉淀 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 误食重金属盐而引起的中毒可服用大量豆浆或牛奶进行解救 |
17.下列关于胶体说法不正确的是( )
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 胶体粒子直径在1 nm~100 nm之间 | |
| C. | 胶体粒子可以透过滤纸,不能透过半透膜 | |
| D. | 胶体带电荷,而溶液呈电中性 |
18.下列各组顺序的排列不正确的是( )
| A. | 酸性强弱:H4SiO4<H2CO3<HNO3 | B. | 热稳定性:HCl>H2S>PH3 | ||
| C. | 金属性:Na<Mg<Al | D. | 熔点:金刚石>食盐>干冰 |