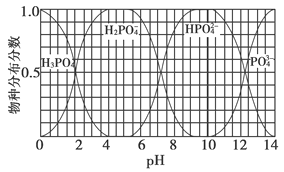
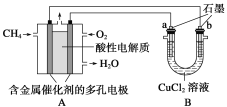
题目内容
【题目】在溶液中加入足量Na2O2后仍能大量共存的离子组是
A. ![]() 、Ba2+、
、Ba2+、![]() 、
、![]() B. K+、
B. K+、![]() 、
、![]() 、
、![]()
C. Ca2+、Mg2+、![]() 、
、![]() D. Na+、
D. Na+、![]() 、
、![]() 、
、![]()
【答案】B
【解析】
Na2O2具有强氧化性,能和水反应生成氢氧化钠和氧气,加入足量Na2O2后仍能大量共存,说明离子不具有强还原性,且与OH-不反应,以此解答。
A.在溶液中加入足量的Na2O2后生成NaOH,OH-与NH4+结合生成弱电解质,则不能共存,故A错误;
B.离子之间不发生任何反应,且与过氧化钠、OH-不反应,可大量共存,所以B选项是正确的;
C.加入过氧化钠后,Ca2+、Mg2+、HCO3-之间反应生成沉淀和水而不能大量共存,故C错误;
D.Na2O2具有强氧化性,与SO32-离子发生氧化还原反应,则离子不能共存,故D错误;
所以B选项是正确的。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二甲醚(CH3OCH3)是一种重要的清洁燃料,也可替代氟利昂作做制冷剂等,对臭氧层无破坏作用.工业上以水煤气(CO、H2)为原料生产二甲醚CH3OCH3的新工艺主要发生三个反应:
2H2(g)+CO(g)![]() CH3OH(g)△H=-90.0kJ·mol-1①
CH3OH(g)△H=-90.0kJ·mol-1①
2CH3OH(g)![]() CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CH3OCH(g)+H2O (g)△H=-24.5kJ·mol-1②
CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.1kJ·mol-1③
CO2(g)+H2(g)△H=-41.1kJ·mol-1③
回答下列问题:
(1)新工艺的总反应3H2+3CO![]() CH3OCH3+CO2的热化学方程式为____________________。
CH3OCH3+CO2的热化学方程式为____________________。
(2)已知一些共价键的键能如下:
化学键 | H-H | C-H | C-O | O-H |
键能(kJ·mol-1) | 436 | 414 | 326 | 464 |
运用反应①计算一氧化碳中碳氧共价键的键能____________kJmol-1。
(3)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,计算此温度下的平衡常数K=____________。