题目内容
【题目】(1)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
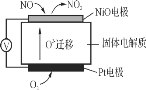
①Pt电极上发生的是_______(填“氧化”或“还原”)反应。
②写出NiO电极的电极反应式:___________________________________。
(2)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:
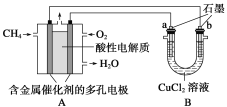
请回答:①甲烷燃料电池负极反应式是_______________________________________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________ g。
【答案】还原 NO+O2--2e-=NO2 CH4-8e-+2H2O=CO2+8H+ :b 6.4
【解析】
(1)根据氧、氮元素的化合价升降来判断得失电子,从而得出正负极来解题;
(2)①酸性条件下,甲烷为原电池的负极,被氧化生成二氧化碳和水;结合电极方程式解答;
②电解池中,阴极上电极反应式为Cu 2++2e-=Cu,阳极上电极反应式为2Cl--2e-=Cl2↑,根据串联电路中转移电子相等计算析出铜的质量。
(1)①铂电极上氧气得电子生成氧离子而被还原,故答案为:还原;
②NiO电极上NO失电子和氧离子反应生成二氧化氮,所以电极反应式为:NO+O2--2e-=NO2,故答案为:NO+O2--2e-=NO2;
(2)①酸性条件下,甲烷为原电池的负极,被氧化生成二氧化碳和水,电极方程式为:CH4-8e-+2H2O=CO2+8H+,
故答案为:CH4-8e-+2H2O=CO2+8H+;
②电解池中,阴极上电极反应式为Cu 2++2e-=Cu,阳极上电极反应式为2Cl--2e-=Cl2↑,连接原电池负极的是阴极,所以B中析出金属的是b电极,当线路中有0.1 mol电子通过时,n(Cu 2+ )=2mol/L×0.05L=0.1mol,铜离子完全析出需要0.2mol电子,所以析出铜的质量=![]() =6.4g,
=6.4g,
故答案为:b;6.4.

【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y![]() 2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数