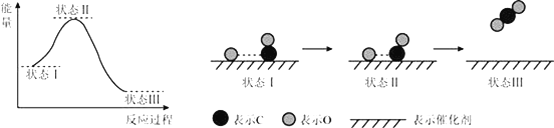
题目内容
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是
A.乙烯和环丁烷(C4H8)的混合气体共28g含有的原子数目为6NA
B.0.1 mol羟基中所含有的电子数为NA
C.1 L0.1 mol·L-1 Na2S溶液中,S2-、 HS-和H2S的微粒数之和为0.1NA
D.在K37C1O3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,若反应中电子转移的数目为10NA则有424g氯气生成
【答案】B
【解析】
A.乙烯和环丁烷(C4H8)的最简式为CH2,28g乙烯和环丁烷的混合气体含3molCH2,故28g乙烯和环丁烷的混合气体含有的原子数目为6NA,A正确;
B.1个羟基(![]() )中含有9个电子,故0.1 mol羟基中所含有的电子数为0.9NA,B错误;
)中含有9个电子,故0.1 mol羟基中所含有的电子数为0.9NA,B错误;
C.硫化钠的物质的量为0.1mol,S元素在溶液中以S2-、HS-、H2S三种形式存在,由元素守恒可知S2-、 HS-和H2S的微粒数之和为0.1NA,C正确;
D.同种元素不同价态的原子之间若发生氧化还原反应元素的化合价只靠近不交叉,在K37C1O3+6H35Cl(浓)=KCl+3Cl2↑+3H2O反应中,氯酸钾中的1个37C1转化为氯气分子中0价氯原子,H35Cl中有5个35Cl转化为氯气分子中0价氯原子,反应中转移5mol电子生成3mol氯气,且氯气中的37C1:35Cl=1:5,故这样的氯气的相对分子质量为![]() ,若反应中电子转移的数目为10NA,则生成6mol氯气,其质量为
,若反应中电子转移的数目为10NA,则生成6mol氯气,其质量为
![]() = 424g,D正确;
= 424g,D正确;
答案选B。

【题目】Y、Z、W、R、M五种元素,位于元素周期表的前四周期,它们的核电荷数依次增大,有如下信息:
元素 | 相关信息 |
Y | 原子核外有6个不同运动状态的电子 |
Z | 非金属元素,基态原子的s轨道的电子总数与p轨道的电子总数相同 |
W | 主族元素,与Z原子的价电子数相同 |
R | 价层电子排布式为3d64s2 |
M | 位于第ⅠB族,其被称作“电器工业的主角” |
请回答下列问题(Y、Z、W、R、M用所对应的元素符号表示):
(1)Z、W元素相比,第一电离能较大的是____,M2+的核外电子排布式为_______。
(2)M2Z的熔点比M2W的______(填“高”或“低”),请解释原因:_____________。
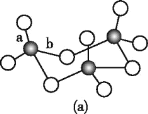
(3)WZ2的VSEPR模型名称为______;WZ3气态为单分子,该分子中W原子的杂化轨道类型为____;WZ3的三聚体环状结构如图(a)所示,该结构的分子中含有____个σ键;写出一种与WZ3互为等电子体的分子的化学式_____。
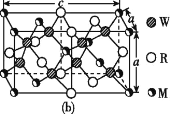
(4)MRW2的晶胞如图(b)所示,晶胞参数a=0.524 nm、c=1.032 nm;MRW2的晶胞中,晶体密度ρ=____g/cm3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA=6.02×1023 mol-1)。